МЕТОДИЧЕСКАЯ РАЗРАБОТКА
интегрированного занятия по дисциплинам биология и химия
Тема: Белки
Разработала: Романова Л.В.,
преподаватель дисциплины биология филиала БПОУ «Чебоксарский медицинский колледж» Министерства здравоохранения Чувашии в г. Канаш
ПОЯСНИТЕЛЬНАЯ ЗАПИСКА
Методическая разработка интегрированного занятия «Белки» составлена согласно Рабочей программы по дисциплине биология для 10 класса, является составной частью раздела «Учение о клетке». Так как данная тема изучается в курсе биологии и химии, то целесообразно проведение интегрированного занятия, что важно для укрепления межпредметных связей, полноты знаний по данной теме.
На занятии изучаются химический состав, строение белков, их физические и химические свойства, рассматривается многообразие и роль беков в живых организмах.
Т.к. данная тема учащимся знакома из курса 9 класса основной общеобразовательной школы, то следует опираться на полученные знания и умело их систематизировать.
Для эффективного усвоения темы изучение нового материала необходимо сопровождать электронной презентацией, проведением демонстрационных опытов и лабораторной работы.
Тип занятия: изучение нового материала
Продолжительность занятия: 2 часа = 90 минут.
Место проведения: классная аудитория.
Цель: создание условий для развития навыков учебной, исследовательской, творческой деятельности, мотивации обучающихся к саморазвитию;
Задачи:
- образовательная (предметная): сформировать знания о составе и строении белков как высшей ступени развития вещества, о химических свойствах и роли белков в организме.
- воспитывающая (метапредметная): развивать познавательный интерес учащихся на основе использования межпредметных связей; формирование научного мировоззрения, создание в представлении учащихся общей, целостной картины, воспитывать культуру труда, осуществлять формирование гигиенических навыков учащихся, заботы о здоровье.
- развивающая (личностная): развитие логического и творческого мышления, познавательного интереса к изучению дисциплин, развитие практических умений и навыков проведения лабораторных опытов и их оформления, работать с учебным материалом, анализировать факты и делать выводы, аргументировать суждения, развивать умение применять знания, полученные на уроках биологии, к анализу явлений или процессов, изучаемых другими науками;
Оборудование и реактивы:
яичный белок, свежие и вареные животные и растительные ткани, раствор сульфата меди (II) и ацетата свинца, концентрированная азотная кислота, этанол, 3%-ный раствор пероксида водорода, вода, спиртовка, пробирки, лучинка, спички.
Средства обучения:
- методическая разработка занятия,
- электронная презентация по теме
Дидактический материал:
- текст о функциях белков,
- тесты для закрепления материала.
План занятия
Организационный момент – 2 мин.
II. Вводная мотивация : постановка целей, изложение плана урока – 3 мин.
III. Изучение нового материала - 58 мин.
Строение и химический состав белков.
Структура белка
Функции белков
Ферменты
Химические свойства белков
Болезни, обусловленные нарушением синтеза функционирования белков
IV. Закрепление : ответы на вопросы, выполнение тестового задания и его проверка - 20 мин.
V. Подведение итогов - 3 мин.
VI. Домашнее задание - 2 мин:
Выучить конспект занятия, решить задачу
VII. Рефлексия – 2 мин.
Преподаватель биологии (II пункт)
Нас ежедневно окружает многообразие живых организмов: от самых крохотных, невидимых микроорганизмов до крупных млекопитающих. Всех их объединяет сложный химический состав. Основой проявления разных свойств жизни являются белки. «Жизнь есть способ существования белковых тел, существенным моментом которого является постоянный обмен веществ с окружающей природой» (Ф.Энгельс)
Преподаватель химии
Внимательно посмотрите на розданные вам приборы и реактивы. О каких веществах будет идти речь на занятии? (один из возможных ответов – о белках)
В организме встречается большое количество разных по функциям белков. Цель нашего урока – изучение химического состава, строения молекул белков, основных химических свойств и роли белков в живых организмах.
Преподаватель биологии
Давайте вспомним, что нам известно о белках. (на доске расписывается все, что говорят обучающиеся в схематичном виде)
- Какие вещества называются белками?
- Какие вещества называются полимерами? Приведите примеры известных вам биологических полимеров.
- Какие химические элементы входят в состав белков?
- Какие вещества являются мономерами белков?
В 1888г. русский биохимик А.Я.Данилевский открыл пептидные группы .
В начале XX века немецкий ученый Фишер синтезировал полипептид из 18 аминокислот.
Преподаватель биологии
Давайте вспомним, что нам
Давайте подытожим все выше сказанное (слово предоставляется одному из обучающихся)
1) Белки – биополимеры, мономерами которых являются аминокислоты. В клетках и тканях встречается свыше 170 различных аминокислот. В составе белков обнаруживается лишь 26 из них; обычными же компонентами белка можно считать лишь 20 аминокислот.
2) Простые белки (протеины) содержат 4 химических элемента – С, Н, О, N, S, в сложных белках имеются ионы металлов
3) Чем сложнее организм, тем больше белков он содержит. В организме бактерии примерно 3-4 тыс. разных белков, а у млекопитающих – уже около 50 тысяч. Большинство белковых молекул достигает гигантских размеров по сравнению с другими органическими соединениями и имеет очень большую молекулярную массу.
Молекулярная формула одного из белков группы пенициллинов – С43Н58N4 O12; казеина – белка коровьего молока – C47 H48N3NaO7S2 ; гемоглобина – C3032H4816O872N780S8Fe4; молекулярная масса альбумина (белка куриного яйца) – 36 000; миозина (белка мышц) – около 500 000. Большинство белковых молекул достигает гигантских размеров по сравнению с другими органическими соединениями и имеет очень большую молекулярную массу.
Строение аминокислоты (Преподаватель химии)
Молекула любой аминокислоты состоит из двух функциональных групп: аминогруппы (-NH2) и карбоксильной группы (-СООН), присоединённых к атому углерода. Общая формула аминокислоты: 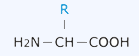
Вторая часть у всех аминокислот разная. Она называется радикалом (R). На схеме эта часть выделена.
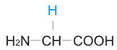
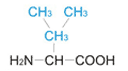
Строение аминокислот глицина (гли) и валина (вал)
Аминокислоты — это бесцветные кристаллические твердые вещества. Чистые аминокислоты, выделенные из белков, имеют сладкий вкус. Они растворяются в воде, а в органических растворителях нет. В нейтральных водных растворах проявляют свойства и кислот, и оснований. Прочие химические свойства зависят от радикала.
Общая формула белков:

Преподаватель биологии. Прошу открыть учебники на стр.________ , также раздаточный материал (Приложение 2) и прочитать текст о строении молекул белков и записать ответы на следующие вопросы. (При наличии вопросов у обучающихся преподаватель должен дать необходимые пояснения)
- Какие структуры белков вам известны?
- Что представляют собой первичная, вторичная, третичная, четвертичная структуры белков?
- Какая структура белков определяет выполнение соответствующих функций белками?
- От какой структуры зависят свойства и функции белков?
Итак, кто ответит на 1-й вопрос?
Преподаватель биологии: В нашем организме содержится великое многобразие белков. Каждый из них играет очень большую роль. Следующий этап занятия связан со знакомством функций белков. С помощью электронной презентации узнаем о разнообразии белков и выполняемых ими функциях. Результатом будет таблица «Функции белков»)
Таблица «Функции белков»
| Функции белка | Примеры |
| Структурная (строительная) | Обязательный компонент всех мембран клетки Коллаген – компонент соединительной ткани (костной, хрящевой, сухожилий) и кожи Кератин – входит в перья, шерсть, волосы, ногти, рога, когти. Эластин – эластичный белок ткани связок, стенок кровеносных сосудов Мукопротеины – основа слизистых секретов |
| Транспортная - | Na-K-АТФаза участвует работу натрий-калиевого насоса (перенос веществ через клеточные мембраны против градиента концентрации) Белки-переносчики осуществляют облегченную диффузию веществ через клеточную мембрану. Цитохромы перемещают электроны в дыхательной цепи и фотосистемах Гемоглобин перености кислород и углекислый газ в крови позвоночных, а гемоцианин – в крови многих беспозвоночных Сывороточный альбумин – жирные кислоты Разные глобулины – гормоны и ионы металлов |
| Двигательная | Тубулины микротрубочек обеспечивают работу веретена деления клетки Актин и миозин обеспечивают сокращение мышечных волокон – так происходят разные движения |
| Рецепторная | Опсин – составная часть светочувствительных пигментов сетчатки глаза Фитохром – сложный светочувствительный белок, участвующий в регуляции реакции растений на изменение длины дня (фотопериодизм) Гликопротеины – антигены тканевой совместимости – ответственны за распознавание «своих» и «чужих» клеток и тканей , являются компонентами гликокаликса |
| Защитная | Антитела – связывают инородные белки, образуя с ними устойчивые комплексы Интерфероны - универсальные противовирусные белки, блокируют синтез вирусного белка в зараженной клетке Тромбопластин, протромбин и тромбин, фибриноген предохраняют организм от кровопотери, образуя тромб Антиоксидантные ферменты –(каталаза) – препятствуют развитию свободнорадикальных процессов Белки кожи – защищают тело позвоночных |
| Ферментативная | Ферменты ускоряют практически все реакции в живых организмах Каталаза разлагет перекись водорода на воду и кислород. Амилаза – гидролиз крахмала до глюкозы, липаза – расщепляет жиры, трипсин – расщепляет белки |
| Регуляторная | Гормоны – белки – инсулин, соматотропин, пролактин Гормоны-пептиды – глюкагон Нейропептиды – присутствуют в мозге и влияют на функцию ЦНС |
| Пищевая и энергетическая | Белки пищи – основные источники аминокислот (Казеин молока – источник аминокислот для детенышей млекопитающих) При полном расщеплении 1г белка выделяется 17,6 кДж энергии |
| Запасающая | Альбумин запасает воду в яичном желтке. Ферритин – запасает железо в печени, селезенке, в яичном желтке Миоглобин – содержит запас кислорода в мышцах позвоночных |
| Антибиотики | Актиномицин, грамицидин |
| Токсины | Микробные – столбнячный, дифтерийный, холерный, ботулинический Токсины змей, пауков, грибов, скорпионов |
Преподаватель химии. Каждый фермент выполняет функцию ускорения одной реакции или одного типа реакции. Давайте экспериментально познакомимся с работой фермента каталазы. На столах имеются необходимое задание и реактивы. Ответьте пожалуйста на приведенные в задании вопросы. (Ответы обсуждаются) Приложение 3.
Преподаватель химии С физическими свойствами белков вы уже познакомились. Какие же у них химические свойства? Для ответа на этот вопрос проведем лабораторный опыт. На столах имеются необходимое задание и реактивы. Я предлагаю вам вместе со мной опытным путем изучить химические свойства известного нам яичного белка.
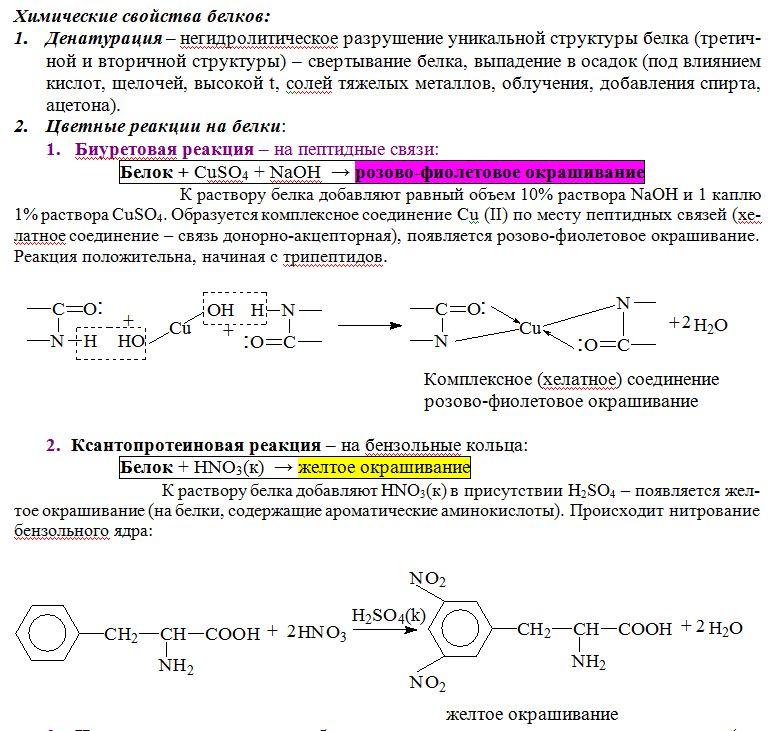
Химические свойства белков
Для белков характерны 3 типа реакций – денатурация, гидролиз, цветные реакции.
Сначала разрушается четвертичная структура (самая слабая), затем третичная, вторичная и при наиболее жёстких условиях первичная. Если изменение условий среды не приводит к разрушению первичной структуры молекулы, то при восстановлении нормальных условий среды полностью воссоздаётся структура белка. Такой процесс носит название ренатурации. Явление денатурации белка знакомо всем: каждый наблюдал, как прозрачное жидкое содержимое яйца после нагревания становится плотным и непрозрачным.
Свойство ренатурации широко используется в медицинской и пищевой промышленности для приготовления некоторых медицинских препаратов, например антибиотиков, для получения пищевых концентратов, сохраняющих длительное время в высушенном виде свои питательные свойства.
Выполнение лабораторной работы по изучению химических свойств белков. (Инструкция прилагается – Приложение 4)
Преподаватель биологии (рассказывает о наследственных заболеваниях, обусловленных нарушением синтеза функционирования белков)
Болезни, обусловленные нарушением синтеза функционирования белков
Белки являются теми химическими соединениями, деятельность которых ведет к формированию нормальных признаков здорового организма. Прекращение синтеза того или иного белка или изменение его структуры ведет к формированию патологических признаков и развитию болезней. Назовем несколько заболеваний, обусловленных нарушением структуры или интенсивности синтеза белков.
Классическая гемофилия обусловлена отсутствием в плазме крови одного из белков, участвующих в свертывании крови; у больных людей наблюдается повышенная кровоточивость
Серповидноклеточная анемия обусловлена изменением первичной структуры гемоглобина: у больных людей эритроциты имеют серповидную форму, число эритроцитов уменьшено в результате ускоренного процесса их разрушения; гемоглобин связывает и переносит меньшее, чем в норме, количество кислорода.
Гигантизм обусловлен повышенным количеством гормона роста; больные имеют чрезмерно высокий рост.
Дальтонизм обусловлен отсутствием пигмента колбочек сетчатки, участвующем в формировании восприятия цвета; дальтоники не различают некоторые цвета.
Диабет связан с так называемой недостаточностью гормона инсулина, которая может быть обусловлена разными причинами: уменьшением количества или изменением строения выделяемого инсулина, уменьшением количества или изменением структуры рецептора инсулина. У больных людей наблюдается повышенное количество глюкозы в крови и развиваются сопутствующие этому патологические признаки.
Злокачественная холестеринемия обусловлена отсутствием в цитоплазматической мембране клеток нормального рецепторного белка, узнающего транспортный белок, переносящий молекулы холестерина; в организме больных нужный клеткам холестерин не проникает в клетки, а в больших количествах скапливается в крови, откладывается в стенке кровеносных сосудов, что ведет к их сужению и быстрому развитию гипертонии в раннем возрасте.
7. Прогрессирующая ксеродерма обусловлена нарушением работы ферментов, которые в норме осуществляют восстановление в клетках кожи участков ДНК, повреждающихся УФ-лучами; больные не могут находиться на свету, так как в этих условиях у них возникают многочисленные кожные язвы и воспаление.
8. Муковисцидоз обусловлен изменением первичной структуры белка, формирующего в наружной плазматической мембране канал для ионов СГ; у больных в воздухоносных путях скапливается большое количество слизи, что ведет к развитию заболеваний органов дыхания
Пришло время вспомнить и закрепить изученный сегодня материал.
Закрепление Тестовый опрос «Белки»
1. Сколько аминокислот образует все многообразие белков? А) 26, Б) 20, В)40, Г) 210
2. Какие элементы входят в состав простых белков?
А) кислород, Б) азот, В) водород, Г) углерод, Д) магний, Е) сера,
Ж) железо, З) фосфор, И) хлор, К) цинк
3. Какая функциональная группа придает аминокислоте кислые, какая – щелочные свойства?
А) кислые – карбоксильная группа, щелочные – радикал,
Б) кислые –радикал, щелочные – аминогруппа,
В) Кислые – карбоксильная группа, щелочные – аминогруппа,
Г) кислые – аминогруппа, щелочные – радикал.
4. Между какими функциональными группами аминокислот образуется пептидная связь?
А)между аминогруппой одной аминокислоты и радикалом другой,
Б) между карбоксильными группами соседних аминокислот,
В) между аминогруппой одной аминокислоты и карбоксильной группой другой,
Г) между аминогруппами соседних аминокислот.
5. Какую структуру как последнюю имеет молекула гемоглобина?
А) первичную, Б) вторичную, В) третичную, Г) четвертичную.
6. Какие связи стабилизируют четвертичную структуру белков?
А) ковалентные, Б) ионные, В) водородные, Г) никаких связей нет
7. Ферменты – это биокатализаторы, состоящие из:
А) белков, Б) липидов, В) нуклеотидов, Г)углеводов
8. Из аминокислотных остатков построены молекулы:
А) углеводов, Б) белков, В) липидов, Г) ) нуклеиновых кислот
9. Гормональную функцию могут выполнять:
А) только белки, Б) белки и липиды, В) только углеводы, Г) белки и углеводы.
10. Белки в клетке выполняют следующие функции:
А) структурная, Б) защитная, В) хранения и передачи наследственной информации,
Г) транспортная, Д) запасная, Е) регуляторная.
Итак: Каковы основные выводы нашего занятия (выводы делаю обучающиеся)
Выводы: Белки –сложные вещества, выполняющие в живых организмах разнообразные функции. Ферменты белковой природы регулируют обмен веществ. При недостатке белков в рационе питания наблюдаются задержка в росте и развитии, разные наследственные болезни.Они легко денатурируют под воздействием спирта, кислот, высокой температуры.
Домашнее задание
Прочитать соответствующие страницы учебников химии и биологии, конспект урока и составить кроссворд по теме из 15 терминов.
Информационное обеспечение занятия
Основная литература
1. Биология. Общая биология. 10-11 классы: учеб. для общеобразоват. учреждений: базовый уровень / [Д.К.Беляев, П.М.Бородин, Н.Н.Воронцов и др.]; под ред. Д.К.Беляева , Г.М.Дымшица; Рос. акад. наук, Рос. акад. образования, изд-во «Просвещение». – 11 изд. – М.: Просвещение, 2017. – 304 с.
2. Габриэлян О.С. Химия. 10 класс. Профильный уровень: учеб. для общеобразоват. учреждений / О.С.Габриелян, Ф.Н. Маскаев, С.Ю.Пономарев, В.И.Теренин; под ред. В.И.Теренина. – 14 изд., стереотип. - М.: Дрофа, 2013
3. Сивоглазов, В.И. Биология. Общая биология. Базовый уровень: учеб. Для 10-11 кл. общеобразовательных учреждений / В.И.Сивоглазов, И.Б. Агафонова, Е.Т.Захарова; под ред. Акад. РАЕН, проф. В.Б.Захарова. – 7-е изд., - М.: Дрофа, 2011. – 381с.
Электронные образовательные ресурсы
1. 1С: Школа.Биология, 10 класс [Электронный ресурс]. – М.: 1С, 2009. – электрон. опт. диск (CD-ROM).
2. Мультимедийное приложение к учебнику В.И.Сивоглазова, И.Б.Агафоновой, Е.Т.Захаровой [Электронный ресурс]. – М.: Дрофа, 2011. – электрон. опт. диск (CD-ROM).
3. Химия. 10 класс. Видеодемонстрации [Электронный ресурс]. – М.: Просвещение, 2010. – Электрон. опт. диск (DVD).
Интернет-ресурсы
Акуленко, Л.В., Угаров, И.В. Биология с основами медицинской генетики : учеб. для студентов образоват. учреждений сред. проф. образования, обучающихся по специальности 060110.51 "Лаб. диагностика" по дисциплине "Биология с основами мед. генетики" / Л. В. Акуленко, И. В. Угаров ; под ред. О. О. Янушевича и С. Д. Арутюнова. - М. : ГЭОТАР-Медиа, 2011. - 368 с. : ил. [Электронная медицинская библиотека] medcollegelib.ru
Чебышев, Н.В., Гринева, Г.Г. биология: учебное пособие. – М.: ГЭОТАР-Медиа, 2010. – 416 с; ил. [Электронная медицинская библиотека] medcollegelib.ru
3. http://school-collection.edu.ru
ПРИЛОЖЕНИЕ 1. Функции белков
1. Строительная функция. Белки участвуют в образовании всех клеточных мембран и органоидов клетки, а также внеклеточных структур.
2. Двигательная функция живых организмов обеспечивается специальными сократительными белками. Например, актин и миозин — специфические белки мышечной ткани.
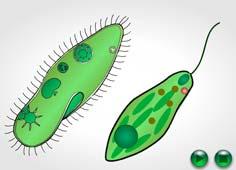 Движение эвглены зеленой и инфузории-туфельки
Движение эвглены зеленой и инфузории-туфельки
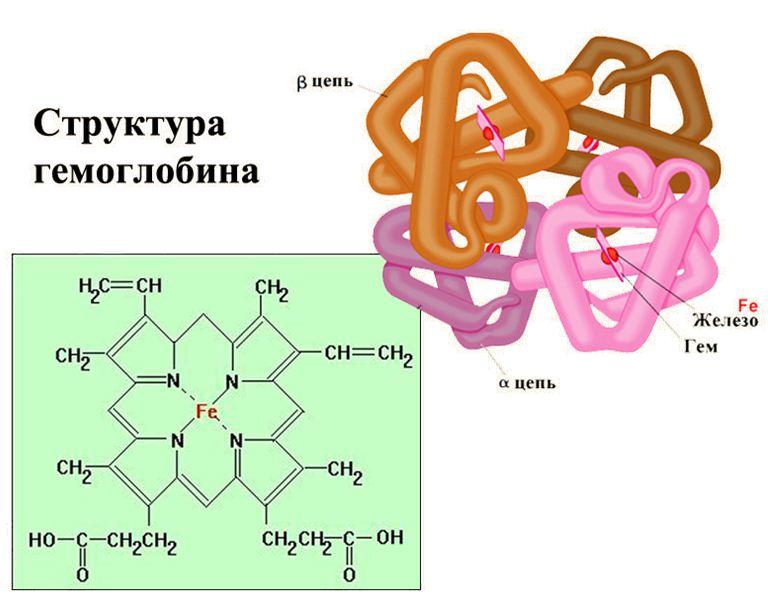
3. Транспортная функция белков заключается в присоединении химических элементов (например, гемоглобин присоединяет кислород) или биологически активных веществ (гормонов) и переносе их к различным органам и тканям тела.

Транспортная функция гемоглобина
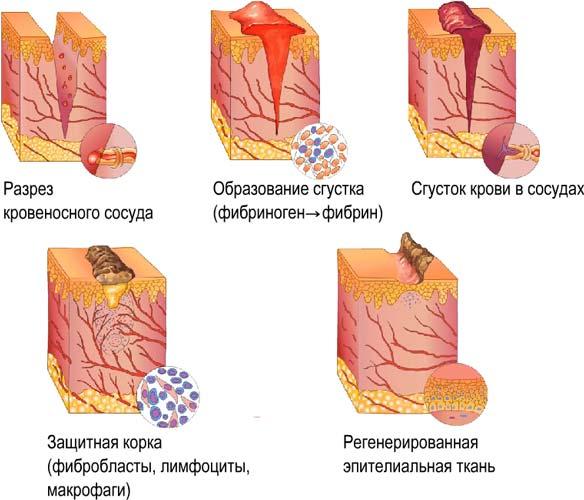
4. Защитная функция. При поступлении в организм чужеродных белков или микроорганизмов в лейкоцитах образуются особые белки — антитела. Другой пример защитной функции: свёртывание белка плазмы крови фибриногена приводит к образованию сгустка крови, что предохраняет от потери крови при ранениях.
5. Энергетическая функция. Белки служат одним из источников энергии в клетке. При полном расщеплении 1 грамма белка выделяется 17,6 кДж энергии.
6. Запасающая функция. К таким белкам относятся резервные белки, являющиеся источниками питания для развития плода. Например, белки яйца (яичный альбумин) и основной белок молока (казеин).
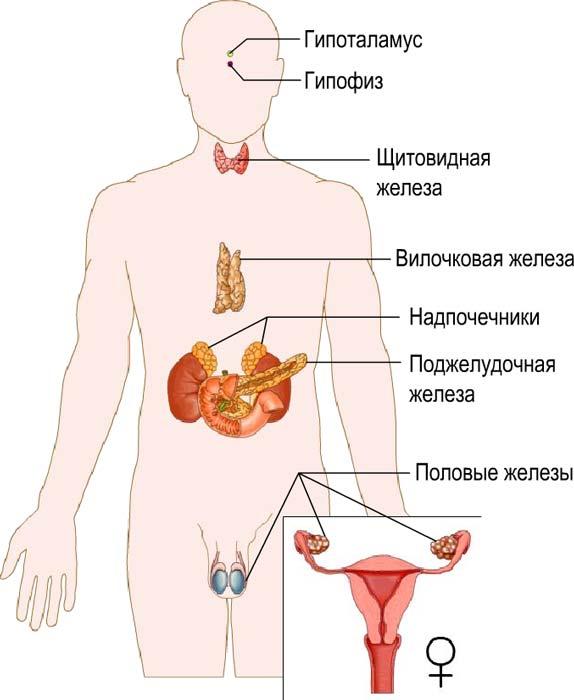
7. Гормональная функция. Обмен веществ в организме регулируется разнообразными механизмами. В этой регуляции важное место занимают гормоны, которые вырабатывают железы внутренней секреции.
8. Каталитическая функция. Большая часть химических реакций, протекающих в организме, регулируется ферментами, т.е. катализаторами.
Ферменты
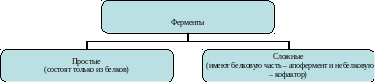
Ферменты – белки, играющие роль биологических катализаторов. Большая часть из них образованы белками с четвертичной структурой.
Вспомните известные вам пищеварительные и другие ферменты. Какова их функция?
Функция фермента – снижение энергии активации реагентов. В молекуле фермента различают активный центр, который соединяется с субстратом. Ферменты высокоспецифичны – фермент и субстрат по своему строению соответствуют друг другу как замок и ключ. Названия всех ферментов заканчиваются на –аза. По типу катализируемых реакций выделяют 6 классов ферментов:
Трансферазы – реакции переноса групп атомов с одного соединения на другое.
Гидролазы – ускоряют реакции гидролиза сложных веществ (расщепления)
Лигазы – ускоряют реакции синтеза.
Изомеразы – регулируют взаимопревращение различных изомеров (глюкозы во фруктозу)
Оксидоредуктазы – катализируют окислительно-восстановительные реакции. 6. Лиазы – реакции разложения с образованием двойной связи и присоединения по двойной связи
Ферменты находятся в клетках в зависимости от катализируемой реакции: ферменты окисления жирных кислот – в митохондриях, расщепления углеводов – в цитоплазме, синтеза нуклеиновых кислот – в ядре, синтеза углеводов – в хлоропластах.
ПРИЛОЖЕНИЕ 2. Строение молекулы белка
Первичную структуру белков определяет последовательность аминокислот. Она образована очень прочными ковалентными связями, названными пептидными. Отсюда и название белков — пептиды. Эти связи образуются в результате выделения молекулы воды при взаимодействии аминогруппы одной аминокислоты с карбоксильной группой другой. Реакция, идущая с выделением воды, называется реакцией конденсации, а возникающая связь — пептидной связью. Соединения, образующиеся в результате конденсации двух аминокислот, представляют собой дипептид. На одном конце его молекулы находится свободная аминогруппа, на другом — свободная карбоксильная группа. Благодаря этому дипептид может присоединить к себе другие аминокислоты

Аминокислотная последовательность белка определяет его биологическую функцию. Замена одной кислоты в молекулах данного белка может резко изменить его функцию.
В гемоглобине людей, страдающих серповидно-клеточной анемией, вместо глутаминовой кислоты имеется валин. Такой гемоглобин кристаллизуется внутри эритроцитов и плохо взаимодействует с кислородом.

Вторичная структура поддерживается водородными связями между группами СО одного витка спирали и NH другого витка спирали, она может быть представлена α-спиралью и β-слоем.
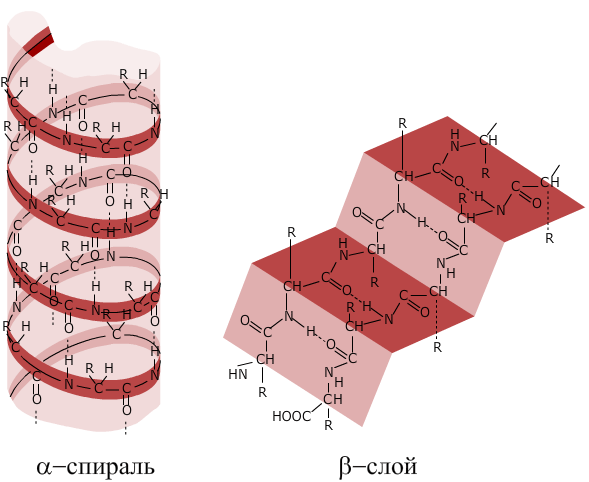

Структура белка фиброина
Рентгеноструктурный анализ показывает, что на один виток спирали приходится 3,6 аминокислотного остатка. Полностью α-спиральную вторичную структуру имеет нитевидный белок кератин. Это структурный белок волос, шерсти, ногтей, когтей, клюва, перьев, копыт и рогов, входящий также в состав кожи позвоночных. Другой тип вторичной структуры (β-слой) — складчатый у белка фиброина, выделяемого шелкоотделительными железами гусениц шелкопряда при завивке коконов, — представлен целиком именно этой формой. Благодаря этому фиброин обладает высокой прочностью и не поддаётся растяжению, но делает шёлк очень гибким. Третий тип вторичной структуры имеет белок коллаген. Здесь три полипептидные цепи свиты вместе. Такой белок тоже невозможно растянуть, что очень важно, так как он образует сухожилия, костную ткань и другие виды соединительных тканей.
 Белок коллаген
Белок коллаген
Учитель химии

Третичная структура белка Четвертичная структура белка
ПРИЛОЖЕНИЕ 3.
Инструкция лабораторного опыта по изучению функции фермента каталазы
Информация. Фермент каталаза катализирует расщепление пероксида водорода с образованием молекул воды и кислорода. Расщепляя Н2О2, каталаза играет защитную роль. Она обезвреживает ядовитое вещество (пероксид водорода), которое непрерывно образуется в клетке в процессе жизнедеятельности. Активность фермента очень высока: при 0°С – 1 молекула катализатора разлагает за 1 секунду до 40 000 молекул Н2О2.
Задание.
Прилейте по 2 мл Н2О2 в пять пробирок с:
а) сырой печенью;
б) вареной печенью;
в) сырым картофелем;
г) вареным картофелем.
Опустите тлеющую лучину во все пробирки (не смачивая).
Ответьте на вопросы.
1. Чем обусловлено расщепление пероксида водорода в пробирках с кусочками сырой печени, сырого картофеля?
2. Почему расщепление пероксида водорода в пробирках с кусочками вареного картофеля и печени не наблюдалось?
Каждый фермент обеспечивает протекание одной или нескольких реакций одного типа и ускоряет химические реакции в десятки и сотни тысяч раз.
ПРИЛОЖЕНИЕ 4.
Инструкция к лабораторной работе
«Химические свойства белков»
1. Биуретовая реакция на определение пептидной связи. Метод основан на способности пептидной связи в щелочной среде образовывать с сульфидом меди окрашенные комплексные соединения.
В пробирку внести 5 капель 1% раствора яичного белка (разведенного дистиллированной водой 1:10), три капли 10% раствора гидрооксида натрия и 1 каплю сульфата меди, все перемешать. Что вы наблюдаете?
2. Ксантопротеиновая реакция. С помощью ксантопротеиновой реакции определяется наличие в белке ароматических радикалов.
К 5 каплям 1% раствора яичного белка добавьте 3 капли концентрированной азотной кислоты (осторожно!) и нагрейте. Что наблюдаете? После охлаждения в пробирку добавьте 5–10 капель 10% раствора едкого натра до появления оранжевого окрашивания (связано с образованием натриевой соли этих нитросоединений).
3. Денатурация белка. Куриный белок растворить в 150 мл воды. Налейте в 3 пробирки по 4–5 мл раствора белка.
А) В пробирку № 1 с раствором белка добавьте этанол неразбавленный. Что произошло с белком?
Б) Пробирку № 2 с раствором белка нагреть на горелке до кипения. Как изменился раствор?
Объясните, почему это произошло? Получившийся осадок попробуйте растворить водой.
В) В пробирку № 3 и 4 с раствором белка медленно при встряхивании по каплям добавьте в одну пробирку насыщенный раствор медного купороса, а в другую – ацетата свинца.
Данный опыт иллюстрирует применение белка, как противоядие при отравлении солями тяжелых металлов.
| Название опыта | Что делали | Что наблюдали | Объяснение и выводы |
| 1. Биуретовая реакция. | К 2 мл раствора белка добавить раствор сульфата меди (II) и щелочи. | Красно-фиолетовое окрашивание. | При взаимодействии растворов образуется комплексное соединение между ионами Си2+ и полипептидами. |
| 2. Ксантопротеиновая реакция. | К 2 мл раствора белка добавить по каплям концентрирующуюся азотную кислоту. | Желтое окрашивание. | Реакция доказывает, что в состав белков входят остатки ароматических аминокислот. |
| 3. Денатурация белка. | В пробирку № 1 с раствором белка добавили этанол неразбавленный. В пробирку № 3 с раствором белка добавили раствор медного купороса. В пробирку № 4 с раствором белка добавили раствор ацетата свинца. | Во всех трех случаях наблюдается необратимое свертывание белка — денатурация. | При нагревании, действии неразбавленного спирта, солей тяжелых металлов происходит разрушение вторичной и третичной струк- туры, с сохранением первичной. |
ПРИЛОЖЕНИЕ 5.
Информационный материал для преподавателя.


 Молекула белка до и после денатурации
Молекула белка до и после денатурации



4. Горение - белки горят с образованием азота, углекислого газа и воды, а также некоторых других веществ. Горение сопровождается характерным запахом жженых перьев.

 Получите свидетельство
Получите свидетельство Вход
Вход












 Методическая разработка интегрированного урока по биологии и химии "Белки" (1.23 MB)
Методическая разработка интегрированного урока по биологии и химии "Белки" (1.23 MB)
 0
0 316
316 9
9 Нравится
0
Нравится
0


