Занятие №3.
Относительная атомная масса.
Мы уже знаем, что атом – это мельчайшая частица вещества.
Из жизненного опыта нам известно, что физические тела обладают определённой массой.
Несмотря на то, что атом ничтожно мал, и его не то что взвесить, но даже увидеть при помощи обычного микроскопа невозможно, учёным удалось определить массы атомов химических элементов. Так, например, масса атома Гидрогена будет равна 1,663·10-24 г (mа(Н) = 1,663·10-24 г). Масса атома Карбона равна 1,994·10-23 г(mа(С)=1,994·10-23 г). Масса атома Оксигена 2,667·10-23 г. Масса атома Урана равна 3,952·10-22 г. С точки зрения математики 1,663·10-24 г – это ничтожно малое число, то есть это такая малая часть от одного грамма, что пользоваться такими числами сложно.
Например, мы знаем, что в одной молекуле воды содержится два атома Гидрогена и один атом Оксигена. Чтобы найти массу одной молекулы нужно удвоить массу атома Гидрогена и к ней добавить массу атома Оксигена, то есть 2·1,673·10-24 г + 2,667·10-23 г = ….. Подсчитывать таким образом массу молекулы крайне неудобно, особенно, если в молекуле вещества много атомов различных химических элементов. Например, для вещества Na2CO3·10H2O или для Ca3(PO4)2.
Для удобства в расчётах химики пользуются не истинными значениями масс атомов химических элементов, выраженных в граммах или килограммах, а относительными атомными массами. Чтобы понять, что собою представляет относительная атомная масса химического элемента, вспомним мультфильм «38 попугаев».
Зверюшки измеряли длину удава не в метрах или сантиметрах, а выбрали условную единицу – длину тела попугая. В длине тела удава поместилось 38 длин тела попугая. Звери сделали вывод: длина удава равняется 38 попугаям, то есть в мультфильме единицей измерения был попугай, вернее длина его тела.
Применим сказанное к атомам. Нужно определить массу атома химического элемента. Вопрос в том, что взять за единицу измерения. Граммы и килограммы не подходят, так как массы атомов составляют ничтожно малую часть от 1 г или 1 кг. Что же взять за условную единицу? Выход был найден. Учёные предложили следующее: «Давайте массу атома Карбона разделим на 12 частей». У нас получится вот что:
1 условная единица = ma(C)/12 = 1,994·10-23 = 1,662·10-24 г = 1 а.е.м., которую стали называть 1 атомная единица массы.
Масса атома Гидрогена 1,663·10-24 г почти совпадает с массой части массы атома Карбона (она равна 1,662·10-24 г).
Масса атома Урана равна 3,952·10-22 г. Посчитаем, сколько раз в массе атома Урана поместится масса части атома Карбона. Для этого массу атома Урана разделим на массу части атома Карбона.
3,952*10-22/1,662*10-24 ≈ 238.

Получается, что атом Урана в 238 раз больше, чем масса условной единицы, то есть 1/12 части массы атома Карбона.
Для атома Нитрогена получим ma(N)/ (1/12*ma(C) = 14.
Для атома Оксигена получим ma(O)/ (1/12*ma(C) = 16.
Для атома Алюминия получим ma(Al)/ (1/12*ma(C ) = 27.
Числа 238, 14, 16, 27 – это соответственно относительные атомные массы Урана, Нитрогена, Оксигена, Алюминия. А в мультфильме это было число 38.
Другими словами, впредь мы будем для подсчёта, например, масс молекул, состоящих из атомов, использовать их массы, выраженные не в привычных для нас граммах или килограммах, а в относительных атомных массах. Осталось запомнить, что относительная атомная масса – это число, показывающее, во сколько раз масса данного атома больше условной единицы, то есть части массы атома Карбона. Относительная атомная масса Урана равна 238. Это число означает, что масса атома урана в 238 раз больше 1 а.е.м.
Обозначается относительная атомная масса так:
Ar (U) = 238, Ar (N) = 14, Ar (O) = 16 и т.д.
Числа эти запоминать не обязательно. Если посмотреть в периодической системе химических элементов Д.И.Менделеева в клеточку с Ураном, то там мы увидим число 238,029 (это более точно подсчитанное число). Для удобства округляем до 238. Находим элемент №7. Там число будет 14,0067. Округляем его до 14. Таким образом, для всех химических элементов значения относительных атомных масс берём из периодической системы химических элементов.
Для всех химических элементов, кроме Хлора, значения относительных атомных масс, взятых из периодической системы химических элементов, округляем до целого числа. Только для Хлора берём число 35,5 (позже я поясню, почему так).
Ar (Cl) = 35,5
Первую таблицу относительных атомных масс составил почти 200 лет назад английский учёный Дж. Дальтон.
В периодической системе химических элементов элементы размещены в порядке возрастания атомных масс. Рассмотри периодическую систему химических элементов и убедись в этом сам.
Домашнее задание. Во сколько раз масса атома Серы отличается от массы атома Оксигена, атома Феррума – от атома Гидрогена, атома Фосфора – от атома Карбона? (Воспользуйся периодической таблицей Д.И. Менделеева).
Правильный ответ будет дан в следующий раз.
Если всё-таки тебе не удалось понять мои объяснения, что такое относительная атомная масса, рекомендую ещё раз всё внимательно прочитать и разобраться.
Считаю уместным на этом занятии дать пояснения о количестве нейтронов в атоме химического элемента.
Весь материал - в документе.

 Получите свидетельство
Получите свидетельство Вход
Вход



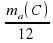 =
= 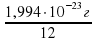 = 1,662·10-24 г = 1 а.е.м., которую стали называть
= 1,662·10-24 г = 1 а.е.м., которую стали называть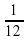 части массы атома Карбона (она равна 1,662·10-24 г).
части массы атома Карбона (она равна 1,662·10-24 г). 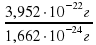 ≈ 238.
≈ 238.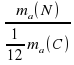 = 14.
= 14.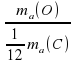 = 16.
= 16.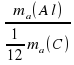 = 27.
= 27.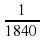 часть а.е.м. Масса протона равна 1 а.е.м. Соответственно масса 11 электронов почти равна нулю, а масса 11 протонов равна 11. Если посмотреть на относительную атомную массу элемента Натрия, то увидим число 22,99. Округляем до 23. Что же получается? Масса атома Натрия 23. Масса 11 протонов равна 11. Массой электронов можно пренебречь. Разница в массе 23 – 11 = 12 и будет массой всех нейтронов. А поскольку масса одного нейтрона равна 1 а.е.м., то количество нейтронов в ядре атома Натрия составляет 12.
часть а.е.м. Масса протона равна 1 а.е.м. Соответственно масса 11 электронов почти равна нулю, а масса 11 протонов равна 11. Если посмотреть на относительную атомную массу элемента Натрия, то увидим число 22,99. Округляем до 23. Что же получается? Масса атома Натрия 23. Масса 11 протонов равна 11. Массой электронов можно пренебречь. Разница в массе 23 – 11 = 12 и будет массой всех нейтронов. А поскольку масса одного нейтрона равна 1 а.е.м., то количество нейтронов в ядре атома Натрия составляет 12.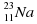 : 11e, 11p, 12n (23-11=12)
: 11e, 11p, 12n (23-11=12)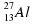 : 13e, 13p, 14n (27-13=14)
: 13e, 13p, 14n (27-13=14)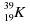 : 19e, 19p, 20n (39-19=20)
: 19e, 19p, 20n (39-19=20)








 Дистанционный материал по химии на тему: "Первоначальные химические понятия" (часть 3) (25.09 КB)
Дистанционный материал по химии на тему: "Первоначальные химические понятия" (часть 3) (25.09 КB)
 0
0 359
359 49
49 Нравится
0
Нравится
0


