Мирозданье постигая, все познай, не отбирая:
Что — внутри, во внешнем сыщешь.
Так примите ж без оглядки
Мира внятные загадки.
Гёте
В данной теме речь пойдёт о типах оптических спектров. Рассмотрим, как происходит поглощение и испускание света атомами. А также поговорим о происхождение линейчатых спектров.
В прошлой теме говорилось о дисперсии света. Дисперсия света — это зависимость показателя преломления среды и скорости света в нем от частоты световой волны.
В 1664–1668 гг. Исаак Ньютон провел серию опытов по изучению солнечного света и причин возникновения цветов с помощью стеклянной призмы. При разложении с помощью трёхгранной призмы белого света, т.е. света в видимом диапазоне, содержащего длины волн в диапазоне 380—760 нм, возникает радужная полоска, которую Ньютон назвал спектром.
В настоящее время для точного исследования спектров такие простые приспособления, как узкая щель, ограничивающая световой пучок, и призма (которые использовал Ньютон), уже недостаточны. Необходимы приборы, дающие четкий спектр, т. е. приборы, хорошо разделяющие волны различной длины и не допускающие перекрытия отдельных участков спектра. Такие приборы называют спектральными аппаратами. Чаще всего основной частью спектрального аппарата является призма. Рассмотрим схему устройства призменного спектрального аппарата.
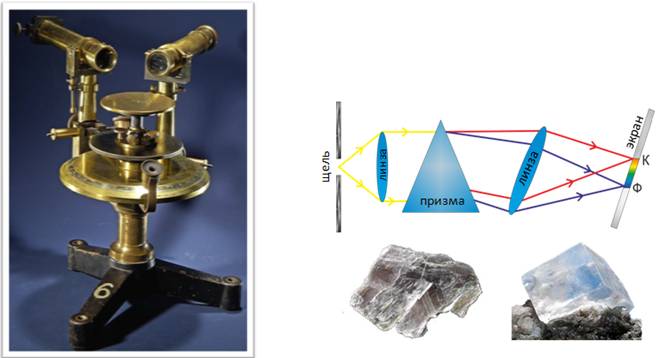
Исследуемое излучение поступает вначале в часть прибора, называемую коллиматором. Коллиматор представляет собой трубу, на одном конце которой имеется ширма с узкой щелью, а на другом - собирающая линза. Щель находится на фокусном расстоянии от линзы. Поэтому расходящийся световой пучок, попадающий на линзу из щели, выходит из нее параллельным пучком и падает на призму, которая может быть изготовлена не только из стекла, но и кварца, соли и т.п.
Так как разным частотам соответствуют различные показатели преломления, то из призмы выходят параллельные пучки, не совпадающие по направлению. Они падают на линзу. На фокусном расстоянии этой линзы располагается экран — матовое стекло или фотопластинка. Линза фокусирует параллельные пучки лучей на экране, и вместо одного изображения щели получается целый ряд изображений. Каждой частоте (узкому спектральному интервалу) соответствует свое изображение. Все эти изображения вместе и образуют спектр. Описанный прибор называется спектрографом.
Если вместо второй линзы и экрана используется зрительная труба для визуального наблюдения спектров, то прибор называется спектроскопом.
Спектральный состав излучений различных веществ весьма различен. Но многочисленные наблюдения и фотографии спектров показывают, что все спектры можно разделить на три сильно отличающихся друг от друга типа, которые определяются состоянием светящегося объекта.
В опыте Ньютона, при пропускании солнечного света через призму, получали спектр в виде сплошной полосы. В ней были представлены все цвета, плавно переходящие один в другой. Такой спектр называется сплошным или непрерывным спектром.
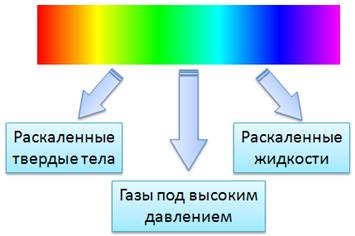
Сплошные спектры излучаются раскаленными твердыми и жидкими веществами, а также газами, находящимися под большим давлением. Это указывает на то, что вид непрерывного спектра и сам факт его существования определяются не только свойствами отдельных излучающих атомов, но и в сильной степени зависят от взаимодействия атомов друг с другом. Основную роль в излучении играет возбуждение атомов и молекул при хаотическом движении этих частиц, обусловленное высокой температурой. Солнце дает сплошной спектр, так как его оболочка состоит из плазмы высокой плотности.
Второй тип спектров — это линейчатые спектры.

Линейчатым называют спектр, состоящий из отдельных резко очерченных цветных линий, отделенных друг от друга широкими темными промежутками.
Например, если внести в пламя газовой горелки кусочек поваренной соли, то пламя окрасится в желтый цвет, а в спектре будут видны две близко расположенные желтые линии, характерные для спектра паров натрия.

Наличие линейчатого спектра означает, что вещество излучает свет только вполне определенных длин волн (точнее, в определенных очень узких спектральных интервалах). Каждая из линий имеет конечную ширину.
Такие спектры получаются от светящихся атомарных газов или паров. В этом случае свет излучают атомы, которые практически не взаимодействуют друг с другом. Это самый фундаментальный, основной тип спектров.
Линейчатые спектры различных химических элементов отличаются цветом, положением и числом отдельных светящихся линий.
И последний тип спектров — это полосатые спектры.

Они состоят из отдельных полос, разделенных темными промежутками. С помощью очень хорошего спектрального аппарата можно обнаружить, что каждая полоса представляет собой совокупность большого числа очень тесно расположенных линий.
Полосатые спектры излучаются отдельными возбужденными молекулами (молекулярный газ). Излучение вызвано как электронными переходами в атомах, так и колебательными движениями самих атомов в молекуле.
Все описанные выше спектры называются спектрами испускания, т.е. спектрами, получаемыми при разложении света, излученного самосветящимися телами.
Однако, кроме спектров испускания, существуют еще так называемые спектры поглощения.
Спектры поглощения получают, пропуская свет от источника, дающего сплошной спектр, через вещество, атомы и молекулы которого находятся в невозбужденном состоянии.

Спектры поглощения твердых и жидких тел обычно имеют вид широких темных полос, закрывающих часть сплошного спектра источника, а в случае атомарных газов или паров они состоят из отдельных черных линий, видимых на фоне сплошного спектра. Пропустив, например, свет от электрической лампы через сосуд с парами натрия, мы получим на сплошном спектре лампы две узкие черные линии в желтой области спектра как раз в том месте, где располагаются желтые линии в спектре испускания натрия. Другими словами, линии поглощения атомов натрия точно соответствуют его линиям испускания.
Совпадение частот линий испускания и поглощения можно наблюдать и в спектрах других элементов, например водорода и гелия.
В 1859 году на основе экспериментальных данных немецкий ученый Густав Роберт Кирхгоф сформулировал закон обратимости спектральных линий: линии поглощения соответствуют линиям испускания, т.е. атомы менее нагретого вещества поглощают из сплошного спектра как раз те частоты, которые они в других условиях испускают.
Спектр атомов каждого химического элемента уникален. Как не бывает двух людей с одинаковым дактилоскопическим узором, или окраской радужной оболочки глаз, или двух китов с одинаковой окраской хвостового плавника, так и не существует двух химических элементов, атомы которых излучали бы одинаковый набор спектральных линий.
Благодаря этому стало возможным появление метода спектрального анализа, разработанного в 1859 году Кирхгофом и его соотечественником немецким физиком Бунзеном. Спектральным анализом называют метод исследования химического состава различных веществ по их спектрам.
Анализ, проводимый по спектрам испускания, называют эмиссионным, а по спектрам поглощения — абсорбционным спектральным анализом.

В основе эмиссионного спектрального анализе лежат следующие факты:
1) Каждый элемент имеет свой спектр (отличается числом линий, их расположением и длинами волн), который не зависит от способов возбуждения.
2) Интенсивность спектральных линий зависит от концентрации элемента в данном веществе.
Для выполнения спектрального анализа вещества с неизвестным химическим составом необходимо осуществить две операции: заставить каким-то образом атомы этого вещества излучать свет с линейчатым спектром, затем разложить этот свет в спектр и определить длины волн наблюдаемых в нем линий. Сравнивая полученный линейчатый спектр с известными спектрами химических элементов таблицы Менделеева, можно определить, какие химические элементы имеются в составе исследуемого вещества. Путем сравнения интенсивности различных линий спектра можно определить и относительное содержание различных элементов в этом веществе.
Спектральный анализ выгодно отличается от химического анализа своей простотой, высокой чувствительностью, а также возможностью определять химический состав отдаленных тел, например звезд. Он используется для контроля состава вещества в металлургии, машиностроении и атомной индустрии. Этот метод применяется также в геологии, археологии, криминалистике и многих других сферах деятельности.В астрономии методом спектрального анализа определяют химический состав атмосфер планет и звезд, температуру звезд и магнитную индукцию их полей.

В процессе изучения и применения линейчатых спектров возникли различные вопросы, которые нельзя было объяснить в рамках классической механики Ньютона. Как, например, объяснить, почему атомы каждого химического элемента имеют свой строго индивидуальный набор спектральных линий? Почему совпадают линии излучения и поглощения в спектре данного элементы? Чем обусловлены различия в спектрах атомов разных элементов? Ответы на эти и многие другие вопросы удалось найти только в начале ХХ в. благодаря возникновению новой физической теории — квантовой механики. Одним из основоположником этой теории был датский физик Нильс Бор. Бор пришел к заключению, что свет излучается атомами вещества. В связи с этим в 1913 г. он сформулировал два постулата:
Первый постулат (его еще называют постулатом стационарных состояний) гласит, что атомная система может находиться только в особых стационарных (квантовых) состояниях, каждому из которых соответствует определенная энергия, находясь на которых атом не излучает и не поглощает энергии.
Стационарным состояниям соответствуют стационарные орбиты, по которым движутся электроны. При движении по стационарным орбитам электроны не излучают электромагнитные волны, несмотря на ускоренное движение. В каждом стационарном состоянии атом обладает определенным квантовым значением энергии.
Второй постулат (или правило частот) гласит, что при переходе атома из одного стационарного состояния в другое излучается или поглощается квант энергии.
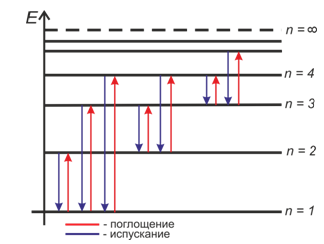
Атомы излучают и поглощают энергию дискретными порциями — квантами, значение которых равно разности энергии тех стационарных состояний, между которыми происходит данный переход.
Состояние атома, в котором все электроны находятся на стационарных орбитах с наименьшей возможной энергией, называется основным. Все другие состояния атома называются возбужденными. У атомов каждого химического элемента имеется свой характерный набор энергетических уровней. Поэтому переходу с более высокого энергетического уровня на более низкий будут соответствовать характерные линии в спектре испускания, отличные от линий в спектре другого элемента.
Совпадение линий излучения и поглощения в спектрах атомов данного химического элемента объясняется тем, что частоты волн, соответствующих этим линиям, а спектре, определяются одними и теми же энергетическими уровнями. Поэтому атомы могут поглощатьсвет только тех частот, которые они способны излучать.
Основные выводы:
– Все спектры испускания можно разделить на три сильно отличающихся друг от друга типа, которые определяются состоянием светящегося объекта.
– Сплошной спектр. Сплошной спектр представляет собойсплошную полосу, в которой все цвета, плавно переходят один в другой.
– Линейчатый спектр. Линейчатым называют спектр, состоящий из отдельных резко очерченных цветных линий, отделенных друг от друга широкими темными промежутками.
– Полосатый спектр. Полосатый спектр состоит из отдельных полос, разделенных темными промежутками.
– Для изучения спектров использую специальные приборы, которые называются спектральными — это приборы, хорошо разделяющие волны различной длины и не допускающие перекрытия отдельных участков спектра.
– Из опыта следует, что атомы могут поглощать свет только тех частот, которые они способны излучать. Это утверждение носит название закона обратимости спектральных линий.
– Спектральный анализ — это метод исследования химического состава различных веществ по их спектрам.
– В процессе изучения и применения линейчатых спектров возникли различные вопросы, ответы на которые дал Нильс Бор в 1913 году, сформулировав два постулата.
– Первый постулат (постулат стационарных состояний) гласит, что атомная система может находиться только в особых стационарных состояниях, каждому из которых соответствует определенная энергия, находясь на которых атом не излучает и не поглощает энергии.
– Второй постулат (или правило частот) гласит, что при переходе атома из одного стационарного состояния в другое излучается или поглощается квант энергии.

 Получите свидетельство
Получите свидетельство Вход
Вход




 0
0 41878
41878

