Цель урока:
Сформировать у обучающихся знания о правилах техники безопасности при работе в химическом кабинете, а также вспомнить из курса 8 класса основные понятия и законы химии.
Задачи урока:
Образовательная: познакомить с правилами по технике безопасности; закрепить знания об основных понятиях химии, а именно: атом, молекула, простые и сложные вещества, валентность; вспомнить формулировки основных законов химии и типы химических реакций.
Развивающая: продолжить развитие навыков самостоятельной, парной и групповой работы, рассуждать, делать выводы, обобщать, анализировать, сравнивать, сопоставлять, переносить ранее усвоенные знания на рассмотрение новых факторов и явлений;
Воспитательная: продолжить воспитание личности, способной критически мыслить в процессе обучения, формирование положительного отношения к учебной деятельности, навыков самообразования, умение слушать и слышать, осознанно и обоснованно вести диалог.
Тип урока: урок закрепления знаний.
Методы урока: словесный, самостоятельный.
Ход урока.
I. Организационный момент:
II. Беседа:
И так ребята, давайте ознакомимся с основными правилами техники безопасности. Все вы знаете, что изучение химии не ограничивается теорией и решением задач. Для усвоения полученных знаний и применения их на практике требуется выполнение лабораторных опытов и практических работ, но перед началом их выполнения, вы должны ознакомиться с правилами ТБ. Каждый ученик должен быть осторожным при работе с огнем и другими возможными источниками возникновения несчастных случаев.
Многие химические вещества едкие и могут вызвать ожоги. Некоторые газы и твердые вещества ядовиты. Иные вещества легко воспламеняются и могут вызвать даже взрыв. При работе с химическими веществами нужно строго соблюдать правила ТБ.
Инструктаж по работе.
Работа проводится по описанию на стр.194 – 195 учебника Химия. 8 класс Н.Н. Нурахметов, издат. «Мектеп» 2012 год.
Правила техники безопасности:
Проводить опыты лишь с теми веществами, которые указаны учителем. Не брать для опыта больше вещества, чем это необходимо.
Строго выполнять указанные учителем меры предосторожности.
Не пробовать вещества на вкус.

При определении запаха веществ не подносите сосуд близко к лицу, ибо вдыхание паров может вызвать раздражение дыхательных путей.
Нагревая пробирку с жидкостью, держите ее так, чтобы открытый конец ее был направлен в сторону и от себя, и от соседей по парте.
Не приступайте к выполнению опыта, не зная этапов проведения опытов.
Банки и склянки закрывайте теми же крышками и пробками, какими они были закрыты изначально. Пробки открываемых склянок ставьте на стол только тем концом, который не входит в горлышко склянки.
Закончив работу, приведите рабочее место в порядок.
Эти правила охватывают общие меры безопасности. Они используются не только в лабораториях или в кабинета, но и в быту. Каждый ученик должен знать эти правила. Овладение химией начинается с изучения правил ТБ.
Ну а теперь давайте вспомним основные понятия химии.
Что такое атом? (Приблизительный ответ учеников: Атомы – это мельчайшие, химически неделимые частицы вещества).
Что такое молекула? (Молекула - это мельчайшая частица, сохраняющая свойства и состав данного вещества.)
Простые и сложные вещества? (Простыми называют такие вещества, состоящие из атомов одного химического элемента(например водород, кислород, железо, алюминий), сложными веществами, состоящие из атомов разных химических элементов(молекула воды состоит из двух химических элементов: кислорода и водорода)).
Валентность? (Валентность – это способность атомов химического элемента присоединять определенное число атомов другого элемента). Например, составить формулу молекулы состоящую из атомов фосфора и кислорода.
Изображение химических элементов и их соединений с помощью химических символов и формул дает возможность записывать реакции химических уравнений.
Химическое уравнение – это условная запись химической реакции с помощью химических формул и коэффициентов.
Вступающие в реакцию, т.е. взаимодействующие между собой вещества, называются реагентами. Вещества образующиеся в результате реакции, называются продуктами.
Вещества состоят из атомов, поэтому при составлении химических уравнений, как вы знаете необходимо пользоваться правилом:число атомов каждого химического элемента исходных веществ должно равняться числу атомов в продуктах реакции. Например: 4Р + 5О2 = 2Р2О5; N2 + 3H2 = 2NH3;
ЗАКОНЫ ХИМИИ:
Закон постоянства состава веществ, гласит: любое сложное вещество независимо от способа его получения имеет постоянный качественный и количественный состав.
Закон постоянства состава веществ впервые сформулировал французский ученый Пруст (1808).
Закон объемных отношений. Закон Авогадро. Молярный объем газа.
Французский ученый Гей – Люссак сформулировал закон объемных отношений: объемы выступающие в реакцию газов относятся к друг другу, а также к объемам получающихся газообразных продуктов как небольшие целые числа.
Весь материал - в документе.

 Получите свидетельство
Получите свидетельство Вход
Вход



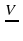









 Конспект урока на тему "Основные понятия и законы химии" (24.66 КB)
Конспект урока на тему "Основные понятия и законы химии" (24.66 КB)
 0
0 3969
3969 797
797 Нравится
0
Нравится
0


