Lesson Theme/Тема урока.
В данном разделе физическая теория применяется для одних из самых ярких и интересных примеров для химии - переходных металлов, давая учащимся понимание и объяснения многим утверждениям, которые они уже встречали в разделе 12. 2B. При желании, этот раздел может быть своего рода приложением к разделу 12. 2B, для комплексного изучения химии переходных металлов.
Learning Objectives/ Цели обучения.
From middle term plan/ С середины плана
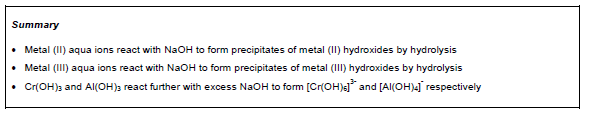
- Понимать поведение и кислотную природу этих ионов и их реакции с раствором аммиака, растворами гидроксидов и растворами карбонатов для получения нерастворимых гидроксидов и комплексных ионов.
Lesson Objectives/ Цели урока.
According to the lesson topic/ В соответствии с темой урока
Учащиеся могут определять структуру аква-иона металлов, проводят эксперименты и на основе полученных данных записывают уравнения реакций.
Language Objective/ Цель языка
Предметная лексика и терминология: Теория/подход Льюиса, теория/подход Бренстеда-Лоури, хелат, комплексный ион, донор протона, акцептор протона, гидролиз, лиганда, замена
Серия полезных фраз для диалога/письма: Эта реакция может быть описана только при помощи/как..... в теории/ / теории, потому что...
Различия между теориями... Сходство между теориями...
Теории сходятся... Теория Льюиса расширяет применимость...
Эта теория/подход применим и к..., а также...
Эта теория/подход не применима к....
Одним из ограничений такого подхода является то, что...
Где могут использоваться оба подхода, они не противоречат.
Ход урока.
Beginning (Starter) / Начало (5мин).
1. Орг момент, приветствие учащихся.
Активити: для создания позитивного настроя на урок, читаю утверждения и прошу учащихся делать шаги, если они согласны с моим утверждением вперед, если нет шаг назад.
Раздать учащимся цветные карточки (4 цвета) на которых написаны буквы: Э – экспериментатор, человек, который будет проводить эксперимент; П – практик, человек, который должен будет записывать уравнения реакций; В – волонтер, человек, который будет защищать свою группу. (всего в классе 12 человек, т. о. образуется 4 группы по 3 человека).
2. Middle (Main activities) / Середина.
Раздать каждой группе лотки с посудой и реактивами, определить цель проведения эксперимента. Раздать карточки подсказки на английском языке, чтобы учащиеся смогли записать уравнения реакций на листе А3.
Готовые листы с реакциями прошу волонтеров прикрепить на доску. Теперь раздаю каждому ученику таблицу, которую они должны заполнить во время выступления волонтеров и проверки результатов экспериментов.
Объявляю следующий этап урока: «Беговая дорожка». В разных концах класса 4 пункта, где учащиеся должны выполнять в группах задания. Каждая группа подходит поочередно к каждому пункту и выполняет задание, как можно быстрей. Финиш будет учитель, который проверяет правильное выполнение заданий.
Учитель проверяет и определяет победителя.
3. End (Plenary) / Конец (пленарное заседание) (5мин)
Попросить учащихся сесть по своим местам, подвести итог урока. У учащихся на столах лежат сигнальные карточки «светофор». Вернуться к целям урока и попросить учащихся поднять зеленую карточку, если было все понятно на уроке; желтую – если что то было не совсем понятно; красную – если тему урока не поняли и следует еще раз ее изучить.
(Такая рефлексия не занимает много времени и дает возможность определить, на сколько учащиеся достигли целей за урок).
Весь материал - в документе.

 Получите свидетельство
Получите свидетельство Вход
Вход
















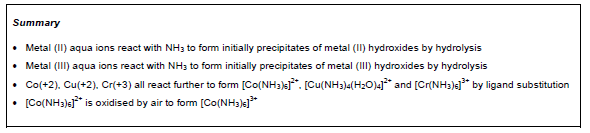











 Практическая работа по химии «Химические реакции комплексных соединений переходных металлов» (1.24 MB)
Практическая работа по химии «Химические реакции комплексных соединений переходных металлов» (1.24 MB)
 0
0 1252
1252 13
13 Нравится
0
Нравится
0


