Конспект урока «Алканы»
Цели:
- сформировать умение составлять структурные формулы органических соединений, используя алгоритм построения, устанавливать причинно-следственные связи между составом, строением и применением веществ;
- отработать навыки пользования номенклатурой IUPAC применительно к алканам;
- ознакомить учащихся с изомерией предельных УВ, их физическими свойствами и основными способами получения.
Оборудование и реактивы: шаростержневые и объёмные модели молекул алканов, образцы парафина, жидкие алканы (пентан, гексан) бензин,
Ход урока
Организационный момент.
Актуализация знаний и умений. Проверка домашнего задания.
Фронтальный опрос класса по теории строения органического вещества А.М.Бутлерова
III. Изучение нового материала.
Алка́ны (также насыщенные углеводороды, парафины, алифатические соединения) — ациклические углеводороды линейного или разветвлённого строения, содержащие только простые связи и образующие гомологический ряд с общей формулой
CnH2n+2.
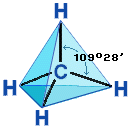
Алканы являются насыщенными углеводородами и содержат максимально возможное число атомов водорода. Каждый атом углерода в молекулах алканов находится в состоянии sp3-гибридизации — все 4 гибридные орбитали атома С равны по форме и энергии, 4 электронных облака направлены в вершины тетраэдра под углами 109°28'. За счёт одинарных связей между атомами С возможно свободное вращение вокруг углеродной связи. Тип углеродной связи — σ-связи, связи малополярны и плохо поляризуемы. Длина углеродной связи — 0,154 нм.
Простейшим представителем класса является метан (CH4).
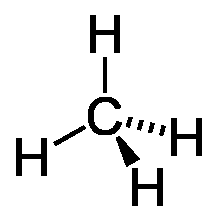
По номенклатуре ИЮПАК названия алканов образуются при помощи суффикса -ан путём добавления к соответствующему корню от названия углеводорода. Выбирается наиболее длинная неразветвлённая углеводородная цепь так, чтобы у наибольшего числа заместителей был минимальный номер в цепи. В названии соединения цифрой указывают номер углеродного атома, при котором находится замещающая группа или гетероатом, затем название группы или гетероатома и название главной цепи. Если группы повторяются, то перечисляют цифры, указывающие их положение, а число одинаковых групп указывают приставками ди-, три-, тетра-. Если группы неодинаковые, то их названия перечисляются в алфавитном порядке.
Названия алканов.
Слово «алкан» того же происхождения, что и «алкоголь». Устаревший термин «парафин» произошел от латинских parum – мало, незначительно и affinis – родственный; парафины обладают малой реакционной способностью по отношению к большинству химических реагентов. Многие парафины являются гомологами; в гомологическом ряду алканов каждый последующий член отличается от предыдущего на одну метиленовую группу СН2. Термин происходит от греческого homologos – соответственный, подобный.
Гомологи – вещества, сходные по строению и свойствам и отличающиеся на одну или более группу СН2 , которые называются гомологической разностью.
Изомерия алканов.
Изомерия – явление существования соединений, которые имеют одинаковый состав (одинаковую молекулярную формулу), но разное строение. Такие соединения называются изомерами.
Характерна структурная изомерия.
1) В формуле молекулы алкана выбирают главную цепь — самую длинную. H3C—CH—CH2—CH—CH2—CH3
-------- | ----------- |
CH3 ¦ CH2—CH2—CH3
---------------------
2) Затем эту цепь нумеруют с того конца, к которому ближе расположен заместитель (радикал). Если заместителей несколько, то поступают так, чтобы цифры, указывающие их положение, были наименьшими. Заместители перечисляют по алфавиту. 1 2 3 4
H3C—CH—CH2—CH—CH2—CH3
| 5 | 6 7
CH3 CH2—CH2—CH3
3) Углеводород называют в таком порядке: вначале указывают (цифрой) место расположения заместителя, затем называют этот заместитель (радикал), а в конце добавляют название главной (самой длинной) цепи. Таким образом, углеводород может быть назван: 2-метил-4-этилгептан (но не 6-метил-4-этилгептан).
| Формула | Название | Число изомеров | Формула | Название | Число изомеров |
| СН4 | Метан | 1 | С11Н24 | Ундекан | 159 |
| С2Н6 | Этан | 1 | С12Н26 | Додекан | 355 |
| С3Н8 | Пропан | 1 | С13Н28 | Тридекан | 802 |
| С4Н10 | Бутан | 2 | С14Н30 | Тетрадекан | 1858 |
| С5Н12 | Пентан | 3 | С15Н32 | Пентадекан | 4347 |
| С6Н14 | Гексан | 5 | С20Н42 | Эйкозан | 366319 |
| С7Н16 | Гептан | 9 | С25Н52 | Пентакозан | 36797588 |
| С8Н18 | Октан | 18 | С30Н62 | Триаконтан | 4111846763 |
| С9Н20 | Нонан | 35 | С40Н82 | Тетраконтан | 62481801147341 |
| С10Н22 | Декан | 75 | С100Н202 | Гектан | около 5,921·1039 |
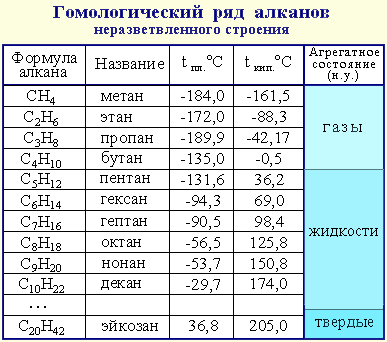
Физические свойства.

Получение
Способы выделения их из природного сырья.
| Природные источники алканов | Способы получения |
Нефть
2. Нефтяной газ
Природный газ Каменный уголь
| Фракционная перегонка. Фракции. 1) ректификационные газы (С3Н8, С4Н10 ) 2) газолиновая фракция (С5Н12 до С11Н24 ) 3) лигроиновая фракция (С8Н18 до С14Н30 ) 4) керосиновая фракция (С12Н26 до С18Н38 ) 5) дизельное топливо (С13Н28 до С19Н36 ) 6) мазут(С18Н38 - С25Н52, С28Н58 - С38Н78) Крегинг: Термический; Каталитический Фракционное разделение газовый бензин пропан-бутановая смесь сухой газ Коксование коксовый газ каменноугольная смола надсмольная вода кокс |
«Синтетические способы получения алканов»
| Способ получения | Химизм реакции |
| Изомеризация | 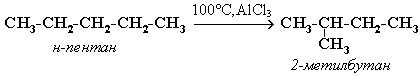
|
| Гидрирование | 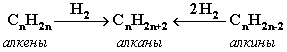
|
| Синтез Вюрца | 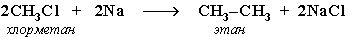
|
| Декарбоксилирование | 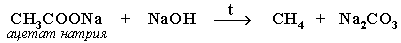
|
| Гидролиз карбидов | 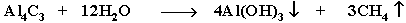
|
Химические свойства
1. Горючесть алканов.
При поджигании (t = 600ºС) алканы вступают в реакцию с кислородом, при этом происходит их окисление до углекислого газа и воды.
СnН2n+2 + O2 ––CO2 + H2O + Q
например:
СН4 + 2O2 ––CO2 + 2H2O + Q
Смесь метана с кислородом или воздухом при поджигании может взрываться.
Наиболее сильный взрыв получается при объёмных отношениях 1 : 2 (с кислородом) или 1 : 10 (с воздухом), т.к. метан и кислород вступают в реакцию полностью.
Подобные смеси опасны в каменноугольных шахтах. Чтобы обеспечить безопасность работы в шахтах, там устанавливают анализаторы, сигнализирующие о появлении газа, и мощные вентиляционные устройства.
С3Н8 + 5O2 ––3CO2 + 4H2O + Q
Горение пропан - бутановой смеси можно продемонстрировать на примере газовой зажигалки.
При горении алканов выделяется много теплоты, что позволяет использовать их в качестве источника энергии. Но большая часть их используется в качестве сырья для получения других продуктов.
2. Разложение алканов.
СnН2n+2 → C + H2 ↑
С4Н10 → 4C + 5H2↑
При сильном нагревании (свыше 10000С) без доступа воздуха метан разлагается на углерод (в виде сажи) и водород:
СН4 → C + 2H2 ↑
Метан в термическом отношении более устойчив, чем другие алканы. Причина этого в достаточной прочности С – Н связей.
В этом процессе промежуточными продуктами могут являться этилен и ацетилен:
2СН4→Н2С=СН2 + 2Н2
2СН4→НС≡СН + 3Н2
3. Реакции замещения (протекают с галогенами и другими окислителями при определённых условиях: свет, температура).
1) Галогенирование:
CH4 + Cl2 → CH3Cl + HCl (хлорметан)
CH3Cl + Cl2 → CH2Cl2 + HCl (дихлорметан)
CH2Cl2 + Cl2 → CHCl3 + HCl (трихлорметан)
CHCl3 + Cl2 → CCl4 + HCl (тетрахлорметан).
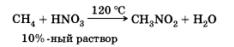
Нитрование ( реакция Коновалова):
Алканы реагируют с 10% раствором азотной кислоты или оксидом азота N2O4 в газовой фазе при температуре 140° и небольшом давлении с образованием нитропроизводных. Реакция так же подчиняется правилу Марковникова.
Механизм цепных реакций достаточно сложен, объяснение ему было дано русским учёным Н.Н. Семёновым, за что он в 1956 г. был удостоен Нобелевской премии.
4. Реакции изомеризации характерны не для всех алканов. Обращается внимание на возможность превращения одних изомеров в другие, наличие катализаторов.
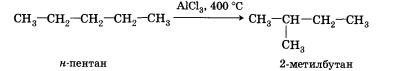
5. Каталитическое окисление метана приводит к образованию важных кислородсодержащих органических соединений.
2CH4 +O2=2CH3OH
Чаще для синтеза этих соединений используют так называемый синтез-газ, который получают при действии на метан водой в присутствии катализатора (Al2O3) и высокой температуры:
Ароматизация:
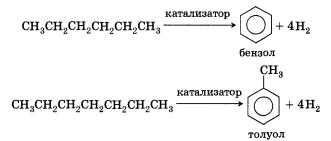
Следует указать, что метан и его гомологи не взаимодействуют в обычных условиях с кислотами и щелочами, окислителями и восстановителями.
Механизм реакции замещения
Стадия 1 – зарождение цепи
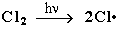
Стадия 2 – рост (развитие) цепи.
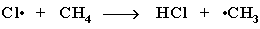
(Реакция Cl· + CH4  CH3Cl + H· не идет, т.к. энергия атомарного
CH3Cl + H· не идет, т.к. энергия атомарного
водорода H· значительно выше, чем метильного радикала ·СН3).
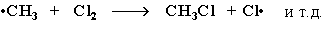
Стадия 3 – обрыв цепи.
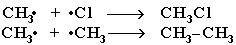
При хлорировании или бромировании алкана с вторичными или третичными атомами углерода легче всего идет замещение водорода у третичного атома, труднее у вторичного и еще труднее у первичного. Поэтому, например, при бромировании пропана основным продуктом реакции является 2-бромпропан:
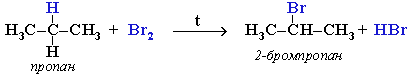
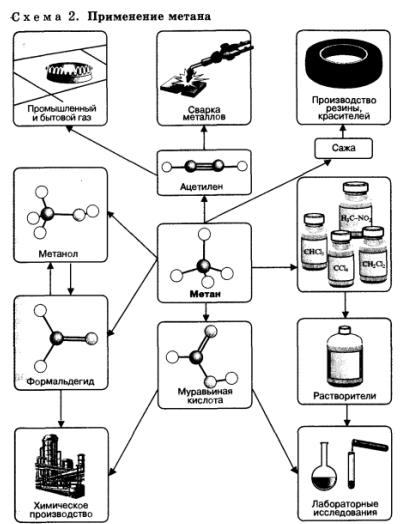
Применение
Домашнее задание:
Учить записи в тетрадях
составить изомеры гептана


 Получите свидетельство
Получите свидетельство Вход
Вход








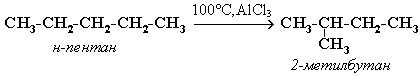
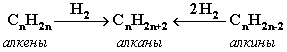


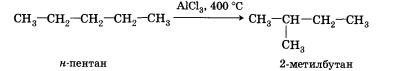

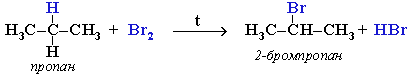










 Конспект урока по химии по теме "Алканы" (0.48 MB)
Конспект урока по химии по теме "Алканы" (0.48 MB)
 0
0 5851
5851 1141
1141 Нравится
0
Нравится
0


