Цели урока:
Образовательные: изучить свойства кислот, щелочей и солей с позиции теории электролитической диссоциации;
Развивающие: развивать мышление, память; умение решать уравнения и работать по таблице;
Воспитательные: воспитывать интерес к предмету.
Тип урока: изучение новой темы
Методы обучения: наглядно - иллюстративный, самостоятельный
Ход урока
Организационный момент урока.
Психологический настрой.
Изучение новой темы.
1. Решение задания. Разложить вещество на катионы и анионы.
|
Вещество |
Катион |
Анион |
|
NaOH |
Na+ |
|
|
Mg(OH)2 |
Mg2+ |
|
|
CaSO4 |
Ca2+ |
|
|
LiH |
Li+ |
|
|
Na2O |
Na+ |
|
2. Диссоциация кислот, оснований и солей в водных растворах
С помощью теории электролитической диссоциации дают определения и описывают свойства кислот, оснований и солей.
Диссоциация кислот
Кислотами называются электролиты, при диссоциации которых в качестве катионов образуются только катионы водорода (H+).
Например,
HCl → H+ + Cl -
HNO3 → H+ + NO3 -
Многоосновные кислоты диссоциируют ступенчато:
Н3РО4 ↔ Н+ + Н2РО - 4 (первая ступень) – дигидроортофосфат ион
Н2РО - 4 ↔ Н+ + НРO2 - 4 (вторая ступень) – гидроортофосфат ион
НРО2 - 4 ↔ Н+ + PОЗ - 4 (третья ступень) – ортофосфат ион
Диссоциация многоосновной кислоты протекает главным образом по первой ступени, в меньшей степени по второй и лишь в незначительной степени - по третьей.
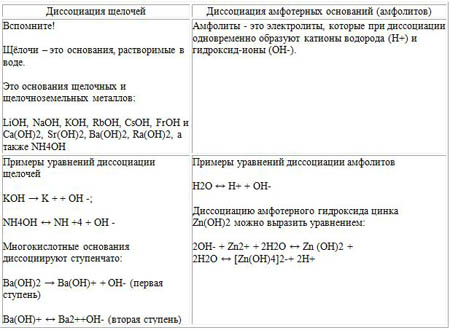
Основания
Основаниями называются электролиты, при диссоциации которых в качестве анионов образуются только гидроксид - ионы (OH - ).
Соли
Солями называются электролиты, при диссоциации которых образуются катионы металлов а также катион аммония (NH+4) и анионы кислотных остатков.
Например, диссоциация средних солей:
(NH4)2SO4 → 2NH+4+ SO2 - 4;
Na3PO4 → 3 Na+ + PO3 - 4
Кислые же и основные соли диссоциируют ступенчато.
Весь материал – смотрите документ.

 Получите свидетельство
Получите свидетельство Вход
Вход












 Урок химии "Электролитическая диссоциация кислот, солей и оснований" (48 КB)
Урок химии "Электролитическая диссоциация кислот, солей и оснований" (48 КB)
 0
0 1671
1671 469
469 Нравится
0
Нравится
0


