
Химия
8 класс
Тема: «Первые попытки классификации химических элементов»
Составила: Петрова Марина Николаевна
учитель МКОУ СОШ № 256 г Фокино Приморского края

Первые попытки классификации химических элементов
До 1200 г. нашей эры человек был знаком с семью металлами:
24 Декабрь, 2016

Но наука никогда не стоит на месте:
В середине XIX века было известно уже 63 химических элемента.
Учёных – химиков того времени волновал вопрос:
«Как классифицировать известные химические элементы?»
24 Декабрь, 2016

Классификация химических элементов на: металлы и неметаллы
Общие свойства металлов:
- Пластичность – способность изменять свою форму при ударе, прокатываться в тонкие листы, вытягиваться в проволоку.
- Электропроводность – способность проводить электрический ток.
- Теплопроводность – способность проводить тепло
- Металлический блеск – хорошо отражают световые лучи.
- Твердое агрегатное состояние (кроме ртути)
Якоб Йен Берцеллиус
24 Декабрь, 2016

Какими признаками обладают указанные вещества?
неметаллы
Графит - углерод
Кремний
Йод
Некоторые неметаллы обладают металлическими признаками
Вывод: классификация элементов на металлы и неметаллы – не верна!
24 Декабрь, 2016

Определить валентность элементов
Классификация элементов по валентности:
I II I II VI II III I IV I I II
H 2 O Na 2 O SO 3 NH 3 CH 4 K 2 S
II II IV II III II II II I I III II
MgO NO 2 Cl 2 O 3 CO HCl Fe 2 O 3
III II V II IV II VII II II II
Al 2 O 3 P 2 O 5 SO 2 Cl 2 O 7 FeO
Франкленд
24 Декабрь, 2016
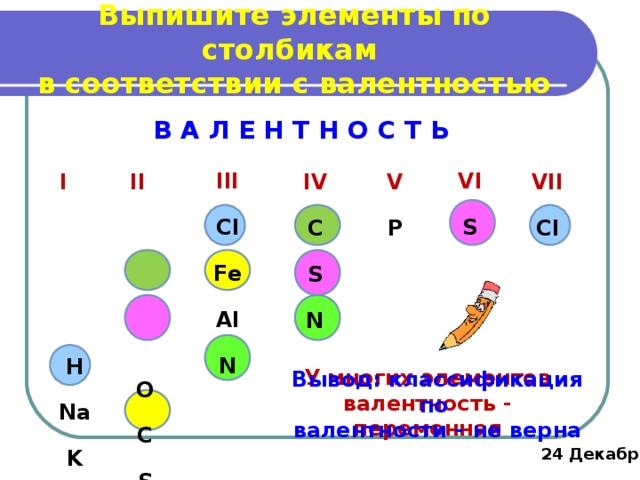
Выпишите элементы по столбикам в соответствии с валентностью
В А Л Е Н Т Н О С Т Ь
VI
S
III
Cl
Fe
Al
N
II
V
VII
IV
I
P
C
S
N
O
C
S
Mg
Fe
Cl
H
Na
K
Cl
У многих элементов валентность - переменная
Вывод: классификация по
валентности – не верна
24 Декабрь, 2016
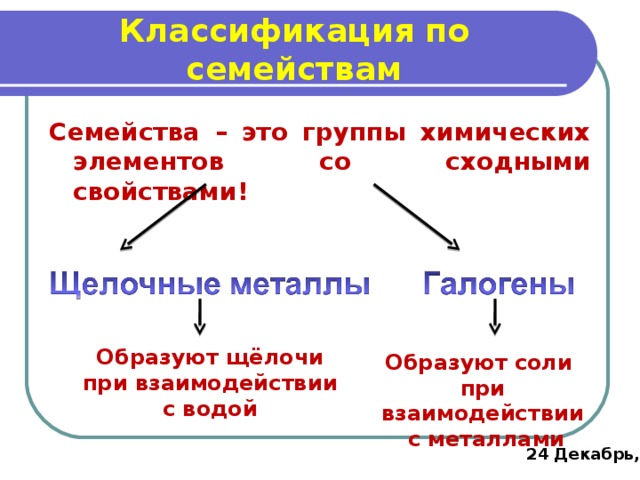
Классификация по семействам
Семейства – это группы химических элементов со сходными свойствами!
Образуют щёлочи при взаимодействии с водой
Образуют соли
при взаимодействии
с металлами
24 Декабрь, 2016
Группы элементов
Периоды
Периодическая система
химических элементов Д.И. Менделеева
VIII
VII
VI
V
IV
III
II
I
Не
Н
2
1
1
1,00797
4.0026
Гелий
Водород
В
Ве
Li
F
N
О
С
N е
4
3
9
10
5
8
6
7
2
15,9994
12,01115
10,811
18,9984
14,0067
20,183
6.939
9,0122
Литий
Бор
Бериллий
Углерод
Азот
Неон
Кислород
Фтор
Ar
Al
М g
Na
S
Cl
P
Si
1 8
14
12
1 3
15
11
1 7
17
3
39,948
28,086
32,064
35,453
30,9738
22,9898
24,312
26,9815
Аргон
Кремний
Фосфор
Сера
Хлор
Алюминий
Магний
Натрий
Ti
22
2 6
21
Sc
Fe
V
2 3
Cr
2 4
М n
2 7
2 8
2 5
К
Ni
Со
С a
20
19
4
58,71
51,996
44 , 956
50,942
47 , 90
44 , 956
55,847
58,9332
40,08
39,102
Никель
Кобальт
Марганец
Железо
Титан
Ванадий
Скандий
Калий
Кальций
Хром
К r
Ge
30
Ga
2 9
Zn
As
С u
Br
Se
36
34
33
35
31
32
63,546
65,37
83,80
79,904
78,96
74,9216
72,59
26,9815
Криптон
Цинк
Медь
Галлий
Германий
Мышьяк
Селен
Бром
45
Rh
Ru
46
Pd
Тс
42
Мо
Zr
40
Nb
41
44
43
39
Rb
Sr
Y
38
37
5
[ 99 ]
101,07
102,905
91,22
88,905
106,4
92,906
95,94
87,62
85,47
Цирконий
Рутений
Молибден
Технеций
Ниобий
Родий
Палладий
Рубидий
Стронций
Иттрий
С d
48
47
Ag
In
Sb
I
Sn
Xe
Т e
51
50
53
52
54
49
112,40
107,868
114,82
126,9044
131,30
78,96
121,75
118,69
Кадмий
Серебро
Ксенон
Теллур
Сурьма
Олово
Индий
Йод
Та
73
Re
74
W
75
77
О s
Р t
Ir
Hf
78
76
72
Ва
La
57
Cs
55
56
*
6
192,2
186,2
180,948
138,81
183.85
178.49
195,09
190,2
137.34
132,905
Гафний
Платина
Рений
Тантал
Иридий
Осмий
Вольфрам
Барий
Цезий
Лантан
А u
Т I
Ро
Hg
80
В i
Pb
At
Rn
79
84
82
86
83
85
81
196,967
200,59
204,37
210
[ 222 ]
207,19
208,980
[ 210 ]
Золото
Ртуть
Свинец
Радон
Висмут
Полоний
Таллий
Астат
106
Sg
104
Rf
105
Db
107
108
Hs
109
М t
Bh
R а
Fr
Ас
89
88
87
**
7
[ 262 ]
[ 263 ]
[ 226 ]
138,81
[ 265 ]
[ 262 ]
[ 266 ]
[ 223 ]
[ 261 ]
Хассий
Дубний
Борий
Резерфордий
Сиборгий
Мейтнерий
Актиний
Радий
Франций
Высшие
оксиды
RO 2
R 2 О
RO
R 2 O 3
R 2 O 7
R 2 O 5
RO 3
RO 4
RH 3
RH 2
RH 4
ЛВС
RH
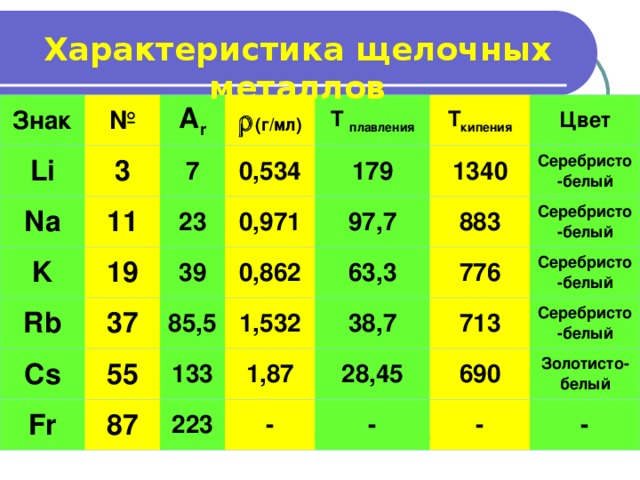
Характеристика щелочных металлов
Знак
Li
№
A r
3
Na
(г/мл)
7
11
K
23
T плавления
0,534
Rb
19
0,971
179
T кипения
39
Cs
37
97,7
1340
Цвет
0,862
Fr
85,5
55
883
Серебристо-белый
87
133
63,3
1,532
Серебристо-белый
38,7
1,87
223
776
713
28,45
Серебристо-белый
-
Серебристо-белый
690
-
Золотисто-белый
-
-

Щелочные металлы –
простые вещества
литий
калий
натрий
рубидий
цезий
24 Декабрь, 2016

Взаимодействие щелочных металлов с водой
I
I
2
2
Na + H 2 O NaOH + H 2
2
24 Декабрь, 2016
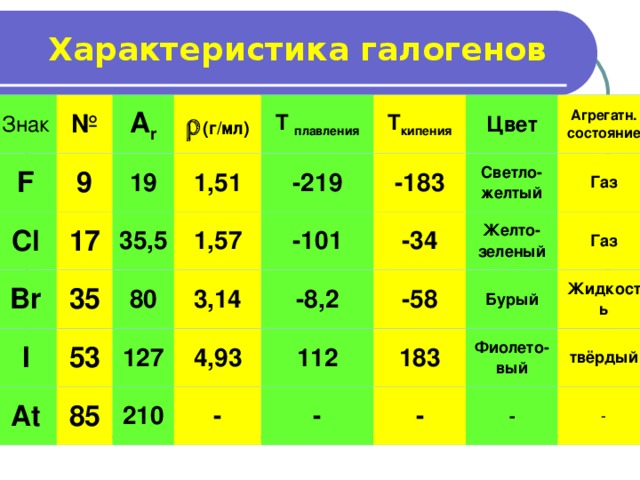
Характеристика галогенов
Знак
F
№
A r
9
Cl
19
(г/мл)
17
Br
1 ,5 1
T плавления
35,5
I
35
T кипения
-219
1 , 5 7
At
53
80
-183
Цвет
85
-101
127
3 , 14
Агрегатн.
состояние
Светло-желтый
-34
4 , 9 3
210
-8 , 2
Газ
-58
-
Желто-зеленый
112
-
Бурый
183
Газ
Фиолето-вый
Жидкость
-
-
твёрдый
-
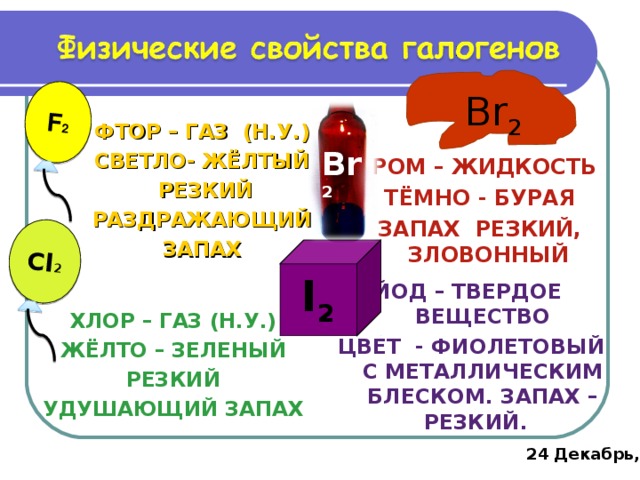
F 2
Cl 2
Br 2
ФТОР – ГАЗ (Н.У.)
СВЕТЛО- ЖЁЛТЫЙ
РЕЗКИЙ
РАЗДРАЖАЮЩИЙ
ЗАПАХ
Br 2
БРОМ – ЖИДКОСТЬ
ТЁМНО - БУРАЯ
ЗАПАХ РЕЗКИЙ, ЗЛОВОННЫЙ
I 2
ЙОД – ТВЕРДОЕ ВЕЩЕСТВО
ЦВЕТ - ФИОЛЕТОВЫЙ С МЕТАЛЛИЧЕСКИМ БЛЕСКОМ. ЗАПАХ – РЕЗКИЙ.
ХЛОР – ГАЗ (Н.У.)
ЖЁЛТО – ЗЕЛЕНЫЙ
РЕЗКИЙ
УДУШАЮЩИЙ ЗАПАХ
24 Декабрь, 2016

Возгонка йода
Возгонка – это переход вещества из твердого агрегатного состояния в газообразное, минуя жидкое.

Определить валентность элементов
CBr 4 N 2 O HF PH 3 SiO 2 Al 2 S 3 Mg 3 P 2
CaO; H 2 S; Cr 2 O 3 SBr 4 Na 3 N Cu 2 O AlF 3
Al 4 C 3 PCl 5 SiO 2 Cl 2 O 5 CaBr 2 Li 3 N CO
24 Декабрь, 2016

Повторение:
1 . Расставьте коэффициенты в следующих
уравнениях реакций. Определите типы реакций:
- СаСО 3 СаО + CO 2
- Na 2 SO 4 + ВаС l 2 Na С l + Ва SO 4
- SO 3 + H 2 O H 2 SO 4
- Cu ( OH) 2 + HNO 3 Cu(NO 3 ) 2 + H 2 O
- Fe(OH) 3 Fe 2 O 3 + H 2 O
- А l 2 (SO 4 ) 3 + NaOH Na 2 SO 4 + А l(OH) 3
р
о
2
с
о
2
2
о
р
2
3
2
3
6
24 Декабрь, 2016

Повторение
2. Напишите уравнения реакций по названиям исходных веществ и продуктов реакций. Определите типы реакций.
А) Сульфат магния + гидроксид натрия →
гидроксид магния + сульфат натрия.
Б) Хлорид калия + нитрат серебра →
нитрат калия + хлорид серебра.
В) Железо + соляная кислота →
хлорид железа ( II ) + водород.
Г) Оксид меди + оксид азота ( V ) → нитрат меди ( II)
Д) Железо + сера → сульфид железа ( II ).
24 Декабрь, 2016


 Получите свидетельство
Получите свидетельство Вход
Вход





























 Презентация по химии "Первые попытки классификации химических элементов" (6.54 MB)
Презентация по химии "Первые попытки классификации химических элементов" (6.54 MB)
 3
3 2471
2471 511
511 Нравится
0
Нравится
0


