Рабочая тетрадь
по химии 8 класс
трехуровневые задания
по технологии ППТМСО
Разработала: учитель химии
сш. № 3 г Атабасар
Сыздыкова Ардак Султансеитовна
Пояснительная записка.
Учитель химии – Сыздыкова Ардак Султансеитовна, ГУ «Средняя школа №3» отдела образования Атбасарского района
Предмет – химия, 8 класс
Название материала – «Рабочая тетрадь по химии, трехуровневые задания» разработан по Караевской технологии.
Количество листов – 30
Предназначение – для самостоятельной работы учащихся
Оборудование – рабочая тетрадь
Форма использования – при фронтальной, парной, индивидуальной работе учащихся
Цель:
- организовать самостоятельную работу учащихся
- умение выделить главное в прочитанном;
- формировать устойчивый интерес к данному предмету.
Работа с тетрадью
Тетрадь предназначена для фронтальной и индивидуальной работы на уроках и внеурочное время. Состоит из заданий 3 уровней;
Основная цель данной рабочей тетради – помочь учителю организовать самостоятельную работу учащихся по формированию основополагающих знаний школьного курса неорганической химии, умения применять их на разных уровнях с учетом возрастных особенностей. Система таких заданий поможет учителю осуществить принципы сотрудничества учащимися в процессе обучения и учета их знаний, умений и навыков. Тетрадь предлагает учащимся задания, вопросы, упражнения разного характера познавательной деятельности (на воспроизведение, частично-поисковые, исследовательские).
Данная рабочая тетрадь поможет развить познавательную деятельность учащихся, их самостоятельности и интереса, повышает прочность и глубину знаний; ликвидирует дефицит общения особенно средних и слабоуспевающих детей.
Первоначальные химические понятия
Вещества и их свойства
1 уровень
В таблицу распределите следующие тела и вещества; стакан, медь, графин, самовар, водопроводный кран, провод, стекло, пробирка, алюминий
| тело | вещество |
|
_________________________________ |
________________________________
|
В таблицу впишите названия трех веществ, из которых можно изготовить данные тела:
| тела | Вещества или материалы |
| 1 | 2 | 3 |
| ложка |
|
|
|
| Стакан |
|
|
|
| кольцо |
|
|
|
Отметьте, к каким явлениям относятся следующие примеры:
А) при прокаливании медная проволока чернеет____________________
Б) газ водород при низкой температуре и высоком давлении образует кристаллы.____________________________________
В) При кипячении вода превращается в пар._________________________
Г) Бензин горит._________________________________________________
Д) железо при высоких температурах превращается в пар._____________
2 уровень
1. Проведите классификацию выданных вам веществ по агрегатному состоянию и цвету; поваренная соль, сахар, сера, стекло, мел, медь, железо, вода, бензин, углекислый газ ( в закрытой колбе).
____________________________________________________________
____________________________________________________________
____________________________________________________________
____________________________________________________________
2. Вместо точек впишите слово «физическое» или «химическое» явление:
А) при добавлении бесцветного вещества к питьевой соде смесь приобретает малиновый цвет. Это _______________ явление.
Б) При опускании кристалликов перманганата калия в воду смесь становится фиолетовой. Это ___________ явление.
В) При скисании молока образуется простокваша. Это ___________ явление.
3 уровень
1. Определите:
А) во сколько раз атом серы тяжелее атома водорода: _____________
Б) во сколько раз атом хрома легче атома свинца: ________________
В) во сколько раз атом магния тяжелее атома углерода: ___________
2. Если молекулярная масса просто число, показывающая во сколь раз данная молекула тяжелее а.е.м., то определите, какая молекула самая тяжелая:
Mr (H2SO4)_________________
Mr (CaO) ___________________
Mr (Fe3O4)_________________
Mr (H2O)___________________
Молекулы и атомы
Запомните! Вещества состоят из молекул – мельчайших частиц, сохраняющих состав и химические свойства этого вещества.
Запомните! Атомы – мельчайшие частицы, из которых построены молекулы, они химически неделимы.
1 уровень
1. Почему недопустимы такие выражения: «атомы вода», «молекулы воздуха»__________________________________
____________________________________________________
2. В каких случаях структурные частицы вещества можно назвать и атомами, и молекулами? ______________________________________
____________________________________________________________
3. Из приведенных ниже формул веществ распределите отдельно простые и сложные вещества: O2- кислород, O3 – озон, H2O- вода, SiO2 – кремнезем, C – графит, CO2- углекислый газ, NaCI – поваренная соль, NaHCO3 – пищевая сода, CH3COOH – уксусная кислота, Cu – медь, Fe – железо.
ПРОСТЫЕ СЛОЖНЫЕ
_____________________ __________________
_____________________ __________________
_____________________ __________________
_____________________ ___________________
4. Дайте определение простого вещества: __________________________
_______________________________________________________________
2 уровень
1 . Напишите химические формулы веществ, в состав которых входят:
А) 1 атом меди и два атома хлора ______________________________
Б) 2 атома железа и 3 атома кислорода __________________________
В) 1 атом магния и 1 атом кислорода ___________________________
Г) 2 атома водорода 1 атом серы 4 атома кислорода _______________
2. В ряду простых веществ подчеркните «лишнее»
А) кислород, водород, железо, вода
Б) сера, пищевая сода, медь хлор
В) алюминий, поваренная соль, уксусная кислота, углекислый газ.
3. Определите число атомов кислорода в следующих соединениях: CO CO2 N2O3 CaSO4 P2O5 P4O6 Mn2O7
___________________________________________________________________________________________
_________________________________________________________________
_________________________________________________________________
3 уровень
1. Определите отношение масс элементов в дисульфиде железа FeS2. Выберите правильный ответ: а) 56:64, б) 28:32, в) 14:16, г) 7:8
 Дано: Решение
Дано: Решение

2. В каких случаях о железе говорят как о химическом элементе:
А) железный гвоздь Fe _________________________________________
Б) окисд железа Fe2O3 (III)______________________________________
В) железный порошок Fe________________________________________
Г) железная окалина Fe3O4______________________________________
3.Химические элементы
1 уровень
1.Допишите правильный ответ
А) Химическим элементом называется _____________________________
_______________________________________________________________
Б) Химическая формула это ______________________________________
_______________________________________________________________
В) Коэффициент пишется перед ____________________________________
Г) Валентность это _______________________________________________
_______________________________________________________________
2.Как пишутся следующие символы: купрум, азот, углерод, ртуть, хлор: ____________________________________________________________
Напишите названия следующих элементов H C O S Fe Cu Ag Au на казахском, русском и латинских языках. ________________________
______________________________________________________________
4. Согласно валентности, найдите и подчеркните «лишний» элемент в каждом ряду;
А) K Na Mg H Li
Б) Ca O AI Zn Ba
В) Cu O Fe C P
2 уровень
1. Составьте химические формулы следующих веществ;
А) белого фосфора (молекула состоит из 4 атомов фосфора) ____________
Б) оксида алюминия (на каждые два атома алюминия приходиться три атома кислорода). __________________________
В) метана (на один атом углерода приходится 4 атома водорода). ________
Г) углекислого газа (на один атом углерода приходится 2 атома кислорода). ____________________
2. Запишите с помощью коэффициентов и знаков химических элементов:
А) три атома калия ______________________________________
Б) пять атомов фосфора __________________________________
В) четыре атома кремния__________________________________
Д) семь атомов водорода __________________________________
3. Определите валентность элементов в соеднениях: H2O HF NH3 H2S CH4 AI2O3 SO3 CO2 P2O5
4. Составьте структурные формулы веществ, предварительно определив в них валентность атомов элементов:
А) NH3 Б) CCI4 В) SO2 Г) HNO3
____________ ____________ ___________ ______________
3 уровень
1. Составьте формулы кислородных соединений следующих элементов согласно их валентности:
А) фосфора ___________________
Б) кремния ____________________
В) серы ________________________
2. Определите валентность в следующих соединениях: H2SO3 H2SO4 FeSO4 H3PO4 Fe2(SO4)3
3. Замените в формулах бинарных соединений знак «Э» на знак того химического элемента, который может образовывать подобное соединение, и назовите эти соединения
А) ЭО2 ______________________________________________________
Б) ЭО3 _______________________________________________________
В) CI2________________________________________________________
Г) ЭS3________________________________________________________
Д) ZnЭ________________________________________________________
Е) ЭN ________________________________________________________
4. Закон постоянства состава,
Закон сохранения массы веществ

1 уровень
Согласны ли вы со следующими утверждениями? «Да», «Нет»
Масса веществ, вступивших в химическую реакцию, равна массе веществ, образовавшихся в результате реакции. _______
2. Каждое химически чистое вещество, независимо от места нахождения и способа его получения, имеет один и тот же состав. ________
Закон постоянства состава вещества сформулировал французский ученый Ж. Пруст ___________
Вступившие в реакцию атомы не исчезают и не возникают вновь, а происходит лишь перегруппировка. Число атомов до и после реакции остается неизменным, поэтому их общая масса также не изменяется; какой была она до реакции, такой же она и сохраняется и после. ____________
Первым на практике открыл и сформулировал закон сохранения массы веществ русский ученый М.В. Ломоносов. _____
2 уровень
1. В пробирке смешаем 8г серы с некоторым количеством порошка железа. После нагревания образовалось 22г сульфида железа. Сколько граммов железа вступило в реакцию.
 Дано Решение
Дано Решение

2. Определите массу фосфора, содержащегося в оксиде фосфора (V) массой 14,2г, если известно, что кислород в нем 8г.
 Дано: Решение
Дано: Решение

3. Какая масса кислорода входит в состав оксида меди и оксида магния, взятых массой по 40г. Выберите правильный ответ:
А) 8г и 12г Б) 8г и 16г В) 16г и 12г г) 8г и 4г
 Дано Решение
Дано Решение

3 уровень
1. Зная, что при образовании сульфида алюминия, алюминий и сера реагируют в массовом отношении 9:16, определите;
А) массу алюминия, который без остатка прореагирует с 24г серы.
Б) что получится после реакции, если в ней хотели соединить 8г алюминия с 8 г серы.
В) массу алюминия и массу серы, которые необходимо взять для получения 15г сульфида алюминия.
 Дано Решение
Дано Решение

2. На основе закона массы сохранения веществ расставьте коэффициенты в данных химических реакциях:
А) Na + H2O ---- NaOH + H2
Б) P2O5 + H2O ----- H3PO4
В) Fe2O3 + AI ------ AI2O3 + Fe
Г) Au2O3 ------- Au + O2
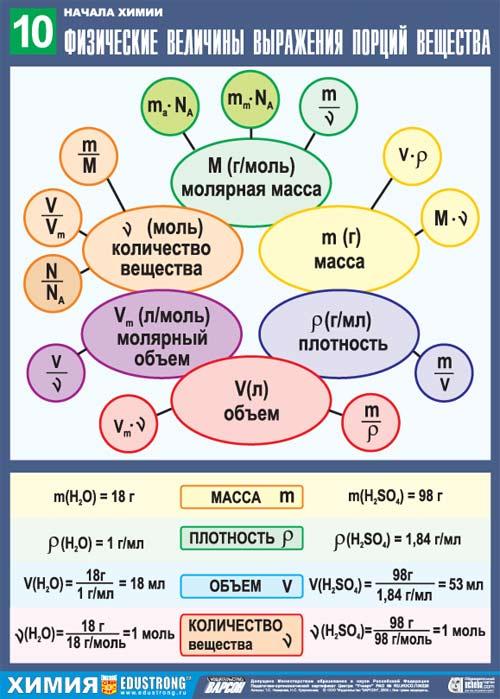
5. Количество вещества. Моль. Молярная масса
Типы химических реакции
Запомните! Для того, чтобы перевести обычную серу массы (г) в количество вещества (ню, нужно разделить ее на молярную массу.
m
Ню=------
M
70г
Например: 70г воды это ---------------- = 3,9 моль
18 г/моль
1 уровень
Выберите правильные ответы.
Количество вещества выражается в
А) молях Б) граммах В) кг Г) г/моль
2. Число Na названо числом
А) Ломоносова Б) Менделеева В) Авогадро Г) Беремжанов
3. Количество вещества, содержащее столько же частиц (атомов, молекул), сколько атомов содержится в углероде массой 0,012кг (12г)
А) молярный объем газа Б) моль В) масса Г) объем
4. При реакций соединения
А) образуется несколько простых веществ;
Б) образуется одно простое вещество
В) образуется одно сложное вещество
Г) образуется несколько сложных веществ
5. При реакций разложения;
А) могут вступать одно простое и одно сложное вещество
Б) может вступать одно простое вещество
В) может вступать одно сложное вещество
Г) могут вступать несколько сложных веществ
6. При реакций замещения
А) образуется два простых вещества
Б) образуется несколько сложных веществ
В) образуется одно сложное вещество
Г) образуется одно сложное и одно простое вещество
2 уровень
1. Определите правильно ли расставлены коэффициенты
А)2Mg + O2 = MgO
Б) 2FeCI2 + CI2 = 2FeCI3
В) 2MgCO3 = 2MgO + 2CO2
Г) 3Na + 2H2O = 3NaOH + H2
2. Расставьте коэффициенты и определите тип химической реакций;
H2O + SO3 ------ H2SO4 ______________________
Mg + O2 ---------- MgO _________________________
H2 + CuO --------- Cu + H2O _____________________
CaCO3 -------------- CaO + CO2 ___________________
Zn + HCI ----------- ZnCI2 + H2 ____________________
CuO + H2SO4 ----- CuSO4 + H2O ________________
3.Определите массу и количества вещества воды, образующейся при сгорании 6г водорода в достаточном количестве кислорода.
 Дано Решение
Дано Решение

3 уровень
1. Определите массу и число атомов железа в 0,2моль сульфата железа (III) Fe2(SO4)3

Дано Решение Формула

2.Определите, какая масса кислорода содержит такое же число молекул, сколько атомов содержится в 4г серы.
 Дано Решение
Дано Решение

3. В реакции образовалось 49г серной кислоты. Определите массу и количество вещества оксида серы (VI), вступившего в реакцию с водой.

Дано Решение

Закон Авогадро. Молярный объем газов
Запомните! Чтобы перевести обычный объем газов (л) в количество вещества (ню), нужно разделить его на молярный объем.
V л
Ню = ----------
Vm молярный объем газа постоянное число 22,4л/моль
10л
н/р 10л газа О2 это ню = --------------- = 0,45моль
22,4л/моль

1 уровень
Ответь на вопросы:
Что такое количество вещества? _________________________________
________________________________________________________________
Что показывает число Авогадро __________________________________
Что такое молярная масса? Поясните примером. ____________________
________________________________________________________________
________________________________________________________________
4. Почему численные значения молярной массы и относительной атомной массы и относительно молекулярной массы одинаковы? Чем эти понятия различаются? ___________________________________________________
________________________________________________________
________________________________________________________
2 уровень
1. Определите сколько атомов, ртути содержится в количестве вещества ртути, равном 0,5 моль.

Дано Решение Формула

2. Сколько молекул сахара С12Н22О11 содержится в чайной ложке сахара массой 5г.
 Дано Решение Формула
Дано Решение Формула

3. Найдите массу и объем (н.у) углекислого газа количеством вещества 2моль.
Д ано Решение Формула
ано Решение Формула

3 уровень
23
На левую чашу весов поместили 1,2 *10 атомов гранул цинка. На правую чашу весов положили;
А) 13 г меди
Б) 2 моля железа
24
В) 0,15 * 10 атомов серы
Рассчитайте массы цинка, железа и серы.
 Дано Решение
Дано Решение

2.При засолке овощей рассол готовят из расчета на 1л воды – 2 неполные чайные ложки (35г) поваренной соли NaCI. Определите, сколько молекул воды приходиться на 1 молекулу соли в полученном растворе.
 Дано Решение Формула
Дано Решение Формула

7. Зачет – общественный смотр знаний учащихся по теме «первоначальные химические понятия»
1 уровень
Ответить на вопросы
Что изучает наука химия?
Что называют веществом?
Перечислите названия тел из следующего перечня; стакан, ложка, свинец, алюминий, льдина, вода, гвоздь, углекислый газ, медная проволока, свеча, сахар.
Что является пределом делимости каждого вещества?
Расскажите о составе воды, формула которой Н2О.
Что называется молекулой?
Перечислите названия чистых веществ из следующего перечня; дистиллированная вода, сахар, медь, гранит, железо, молоко, морская вода, сера, почва.
Какие способы разделения смеси вам известны? Перечислите их.
Придумайте одно предложение, где говорится о железе как о простом веществе, и одно, в котором речь идет о железе как о химическом элементе.
Что называют химическим элементом?
2 уровень
1. Напишите формулу оксида меди (II) и вычислите массовую долю меди в этом веществе.
 Дано Решение
Дано Решение

2.Напишите формулы соединений натрия, хлора, кальция, алюминия с кислородом. Расставьте коэффициенты и укажите типы химических реакций.
_________________________________________________________________
_________________________________________________________________
_________________________________________________________________
_________________________________________________________________
_________________________________________________________________
3. Выведите химическую формулу вещества, если известно, что оно содержит 37,7% натрия, 23% кремния, 39,3% кислорода. Относительная молекулярная масса вещества равна 122.
 Дано Решение
Дано Решение

3 уровень
1. Металл реагирует с кислородом в массовом отношении 3:2. Напишите уравнение реакции окисления и определите, какой Ме, если известно, что его валентность равна двум.
 Дано Решение
Дано Решение

2. Чему равно количество (в молях) сульфата натрия, содержащееся в 300ег его 25%-ного по массе раствора?

Дано Решение

Кислород. Оксиды. Горение
Примерно века два назад
Открыт он был случайно.
Сейчас знаком с ним стар и млад.
Он для вас не тайна.
Известно, что горят отлично
В нем сера, фосфор, углерод,
Железо, магний. Энергично
Сгорает также водород.
Без газа этого на свете
Не жили б звери и народ.
Его назвать могли бы дети,
Ведь это - …
1 уровень
Дайте общую характеристику химического элемента кислорода.
Химический знак ___________________________________
Относительная атомная масса_________________________
Валентность _______________________________________
Химическая формула________________________________
Относительная молекулярная масса ____________________
Образует два простых вещества __________________
Физические свойства ___________________________
Перечислите химические свойства _________________
2 уровень
1. Расставьте коэффициенты и закончите уравнения горения простых, сложных веществ;
А) СН4 + О2=
Б) С6Н6 + О2 =
В) AI + O2 =
Г) S (VI) + O2=
Д) Mg + O2=
Составьте схему:
 Качественный состав _____________________
Качественный состав _____________________
О
 ксиды количественный состав____________________
ксиды количественный состав____________________
Образуется в реакциях _____________________
Вычислите массу оксида углерода (IV) в количестве веществе;
А) 2 моль, Б) 0,5моль В) 0,1моль
4. На основании данных составьте термохимическое уравнение реакции:
А) При взаимодействии 14г железа (III)с серой (II) выделяется 24,3кДж.
Б) При взаимодействии 28г железа (III)с серой (II) выделяется 48,6кДж.
В) При взаимодействии 116г железа (III)с серой (II) выделяется
194,4 кДж.
3 уровень
1. Какая химическая реакция протекает при горении древесины. Составьте уравнение этой реакции, считая, что основная часть древесины – целлюлоза имеет простейший состав С6Н10О5.
________________________________________________________________
________________________________________________________________
2. В каком случае кислорода получится больше по массе, если взять:
10 г воды или 10г оксида ртути. Сделайте расчет.
 Дано Решение
Дано Решение

3. В 3-литровую банку, заполненную кислородом, внесли тлеющий уголек массой 0,3г. Сгорит ли весь уголек? 1л кислорода при н.у имеет массу 1,43г.

Дано Решение

Водород. Кислоты. Соли
Я – газ легчайший и бесцветный,
Неядовитый и безвредный,
Соединяясь с кислородом,
Я для питья даю вам воду.
1 уровень
Перечислите, где и в каком виде (простое вещество, элемент) водород встречается на нашей планете, за ее пределами. ____________________
________________________________________________________________
Составьте уравнения химических реакций получения водорода;
А) под действием на соляную кислоту натрием. ______________________
_______________________________________________________________
Б) разложением природного газа метана СН4_________________________
________________________________________________________________
Составьте два предложения, в одном из которых говорится о водороде как о простом веществе, в другом – как о химическом элементе. ______
_______________________________________________________________
_______________________________________________________________
Перечислите физические свойства водорода, которые сходны с физическими свойствами кислорода: ____________________________
_______________________________________________________________
2 уровень
1. Составьте уравнения реакции взаимодействия водорода с указанными простыми и сложными веществами;
А) с кислородом и хлором _________________________________________
________________________________________________________________
Б) с оксидом никеля (II) и оксидом железа (III)________________________
________________________________________________________________
Даны вещества; магний, кислород, оксид меди (II), соляная кислота. Составьте уравнения химических реакций, в результате которых из данных веществ можно получить; медь, водород, воду, оксид магния.
____________________________________
____________________________________
____________________________________
____________________________________
Даны вещества; алюминий, кислород, соляная кислота, оксид свинца (II). Составьте уравнения химических реакций, указав условия протекания, в результате которых можно получить не менее четырех новых веществ. ______________________________________________________________
_______________________________________________________________
_________________________________________________________________
_________________________________________________________________
3 уровень
1. Заполните таблицу формулами солей, образованных указанными кислотами и металлами. Под формулами солей укажите их названия и составьте уравнения реакции.
| Формула Ме | HCI | H2SO4 | HNO3 | H3PO4 |
| K
|
|
|
|
|
| AI
|
|
|
|
|
| Ag
|
|
|
|
|
| Cu
|
|
|
|
|
При сгорании фосфора в кислороде образуется оксид фосфора (V). Вычислите, хватит ли 6л кислорода (н.у) для сжигания 6,2г фосфора.

 Дано Решение
Дано Решение
Дана медная пластинка. Как обратить ее химическим путем в порошок металлической меди? Приведите уравнения реакций, которыми нужно воспользоваться. Какое химическое свойство проявляет водород?
________________________________________________________________
________________________________________________________________
Вода. Растворы. Основания
Единственное вещество в природе, которое в земных условиях существует во всех трех агрегатных состояниях; жидком (вода), твердом (лед) и газообразном (пар)
Запомните! Массовая доля растворенного вещества – это величина, которая;
А) показывает отношение его массы к массе раствора.
Б) обозначается W (омега)
В) измеряется в долях единицы или в процентах %.
1 уровень
1. Вода - ____________________________________________ вещество.
2. Химическая формула воды __________________________
3. Качественный состав воды __________________________
4. Количественный состав воды ________________________
5. Относительная молекулярная массы воды ______________
2 уровень
Составьте уравнения реакций взаимодействия воды с натрием, кальцием, магнием, оксидом серы (IV), оксидом натрия. Укажите условия течения реакций, назовите продукты;
А) _______________________________________________________
Б) ________________________________________________________
В) ________________________________________________________
Г) ________________________________________________________
Д) ________________________________________________________
2. Кислородосодержащие кислоты способны разлагаться на воду и соответствующий оксид неметалла. Составьте уравнения реакций разложения следующих кислот.
А) угольной кислоты ________________________________________
Б) кремниевой кислоты ______________________________________
В) сернистой кислоты ________________________________________
3. Какая масса воды потребовалась для реакций с 11,2г оксида кальция при получении гидроксида кальция?

Д ано Решение
ано Решение
3 уровень
1. Смешали 200г 10%-ного раствора и 300г 30%-ного раствора соли. Определите массовую долю соли во вновь полученном растворе.
Д
 ано Решение
ано Решение
В какой массе воды надо растворить 11,2л хлора, чтобы получить раствор с массовой долей хлора 1%?
Д
 ано Решение
ано Решение
Массовая доля насыщенного раствора иодида натрия при 20С составляет 0,641. Вычислите растворимость иодида натрия при 20С (на 100г воды).
Д
 ано Решение
ано Решение
Обобщение сведений о важнейших классах
неорганических соединений
1 уровень
Дополните ответ
1. Оксиды это _____________________________________________________
_________________________________________________________________
2. Оксиды классифицируются _______________________________________
3. Основания это __________________________________________________
_________________________________________________________________
Основания классифицируются __________________________________
Кислоты это __________________________________________________
________________________________________________________________
Кислоты классифицируются ____________________________________
________________________________________________________________
Соли это _____________________________________________________
________________________________________________________________
Соли классифицируются _______________________________________
________________________________________________________________
2 уровень
1. Пользуясь схемой генетической связи всех классов неорганических соединений, напишите химические свойства оксидов, кислот, солей оснований;
А) основной оксид + кислотный оксид _____________________________
Б) основной оксид + кислота ______________________________________
В) основание + кислота ___________________________________________
Г) щелочь + кислотный оксид ______________________________________
Д) нерастворимое основание при температуре ________________________
Е) кислота + Ме _________________________________________________
Ж) кислота + соль _______________________________________________
З) разложение солей слабых кислот ________________________________
2. Пользуясь схемой генетической связи, получите соли всеми возможными способами;
А) хлорид натрия ______________________________________________
______________________________________________________________
______________________________________________________________
______________________________________________________________
Б) хлорид серебра ______________________________________________
______________________________________________________________
______________________________________________________________
______________________________________________________________
В) сульфат бария _______________________________________________
______________________________________________________________
______________________________________________________________
______________________________________________________________
Д) сульфат меди (II) ____________________________________________
_______________________________________________________________
_______________________________________________________________
_______________________________________________________________
3 уровень

1. При разложений бертолетовой соли KCLO3, которая была в 20г смеси с KCL, образовалось 12,32г KCL. Определите массовую долю (омега) KCLO3, в исходной смеси.
Дано Решение

2. Смесь, образовавшуюся при сливании растворов, содержащих 10г NaOH и 14,7г H2SO4, выпарили досуха. Вычислите массу (в граммах) сухого остатка.

Дано Решение

Оксиды
1 уровень
1. Классифицируйте и впишите в таблицу следующие солеобразующие оксиды: SO2 Na2O N2O5 BaO CrO3 CuO CrO Mn2O7 CaO
| Основные оксиды |
|
| Кислотные оксиды |
|
2. Запишите названия и дайте классификацию следующим оксидам:
| оксиды | название | Классификация
|
| N2O3 |
|
|
| MgO |
|
|
| CL2O7 |
|
|
| SiO2 |
|
|
| SO3 |
|
|
| FeO |
|
|
| CO2 |
|
|
| CO |
|
|
| NO |
|
|
2 уровень
1. Пользуясь схемой генетической связи всех классов неорганических соединений, напишите химические свойства оксидов:
А) основной оксид + кислотный оксид= …………
CaO + …………………………………
Na2O + ……………………………….
Б) основной оксид + кислота = ……………………….
CaO + ……………………………………
Na2O + …………………………………..
В) основной оксид + вода= ………………………………….
CaO + ………………………………………..
Na2O +……………………………………..
2. Получение основных оксидов
А) Ме + кислород= …………………………..
………. + …………………..= ………………………..
………. + …………………. = …………………………
Б) Неметалл + кислород= ……………………………..
…………… + ………………….= ………………………
…………… + ………………….= ………………………
В) Разложение нерастворимых оснований
……………………..= …………….. + …………………
……………………. = ……………. + ………………….
3 уровень
1.Осуществите следующие превращения
Ме----------------МехОу---------------Ме(ОН)х---------------соль
НеМе--------------- НеМехОу-------------- кислота------------ соль
2. Определите массу соли, которая получится при взаимодействии 15г оксида магния с соляной кислотой массой 15г.
Основания
1 уровень:
1. Классифицируйте основания и назовите их: NaOH KOH LiOH Fe(OH)2 Cu(OH)2 AL(OH)3 Fe(OH)2 Cr(OH)3
2. Заполните таблицу по этим же формулам:
| Одно кислотные | Двух кислотные | Трех кислотные |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 уровень:
Составьте уравнения реакций в соответствии со схемой:
Ме -------------- МехОу------------- Ме(ОН)х для следующих металлов: барий, рубидий, магний, кальций, литий
1)______________________________________________________________
2) ______________________________________________________________
3) ______________________________________________________________
4) ______________________________________________________________
5) ______________________________________________________________
Составьте уравнения реакций по схемам:
А) основание + кислотный оксид = соль + вода
…………… + ……………….= ………………. + ………………..
…………… + ……………….= ………………. + ………………..
Б) основание + кислота= соль + вода
…………… + ……………….= ………………. + ………………..
…………… + ……………….= ………………. + ………………..
В) основание + соль = нерастворимое основание + новая соль
…………… + ……………….= ………………. + ………………..
…………… + ……………….= ………………. + ………………..
Г) разложение некоторых оснований
……………….= ………………. + ………………..
……………….= ………………. + ………………..
3 уровень
Определите массу кислоты, которая потребуется для нейтрализации 0,6 моля гидроксида натрия: А) азотной; Б) серной; В) соляной; Г) фосфорной кислоты. Составьте текст обратной задачи, используя полученные результаты.
Через 10%-ый раствор гидроксида калия массой 100г пропустили достаточное количество хлороводорода. Сколько молекул воды содержит полученный раствор?.
Кислоты
1 уровень
Заполните таблицу
| Формула кислоты | Название кислоты | Формула кислотного остатка | Валентность кислотного остатка |
| HNO2 |
|
|
|
| HNO3 |
|
|
|
| H2SO3 |
|
|
|
| H2S |
|
|
|
| H2SO4 |
|
|
|
| H3PO4 |
|
|
|
| HCL |
|
|
|
| HF |
|
|
|
| H2SiO3 |
|
|
|
| H2CO3 |
|
|
|
| H2CrO4 |
|
|
|
| H3CrO3 |
|
|
|
Назовите и классифицируйте следующие кислоты:
HCL H2S HNO3 H2SO4 H2CO3 H3PO4 H3BO3 H3AsO4 HBr
А) кислородосодержащие__________________________________________
Б) бескислородные _______________________________________________
В) одноосновные ________________________________________________
Г) двухосновные ________________________________________________
Д) трехосновные _________________________________________________
2 уровень:
1. Составьте уравнения реакции в соответствии со схемой:
Неметалл -----оксид неметалла -------------кислота
S ……………………………………………………………………
C (IV)……………………………………………………………….
P (V)…………………………………………………………………
2.Закончите уравнения реакций:
1. Cu + HCL = …………………. + …………………………
2. AL + H2SO 4 = ……………….. + …………………………
3. Na + H3PO4= ………………….. + ………………………
4. Mg + HNO3 = …………………. + ………………………….
3 уровень
Составьте уравнение реакции и назовите ее тип, если известно, что 1 моль неизвестной кислоты реагирует с 1 моль неизвестного оксида. В результате реакции образуется 1 моль воды и 1 моль соли, раствор которой имеет голубую окраску.
С какими из предложенных веществ будет реагировать разбавленная серная кислота? Составьте уравнения возможных реакций. Назовите вещества и определите тип реакций.
А) лакмус………………………………………………………………………
Б) оксид кальция ………………………………………………………………
В) оксид меди ………………………………………………………………….
Г) медь (II) ……………………………………………………………………..
Д) магний ………………………………………………………………………
Е) оксид фосфора(V) ………………………………………………………….
Соли
1 уровень
1. Классифицируйте и назовите следующие соли: Na2SO4 K3PO4 CaCO3 KHSO4 ALPO4 Fe(NO3)3 Cr2(SO4)3 Ca(HCO3)2 KCr(SO4)2 K2Mg(SO4)2 AL(OH)2CL MgOHCL
А) средние …………………………………………………………………….
Б) кислые ………………………………………………………………………
В) основные ……………………………………………………………………
Г) двойные ……………………………………………………………………..
2.Закончите лист рассказа:
Соли это …………………………………………………, молекулы которых состоят из атомов …………… и ………………………………. Соли широко ………………………. В природе. Они образуют многие…………… Соли классифицируют ………………., …………………, ……………………, ……………………………… Соли это ………………….. вещества, преимущественно ……………. цвета. Они разделяются на ……………………………………. в воде, …………………….. в воде и практически ……………………….. в воде. Соли применяются во всех …………………. хозяйства. Они являются важным ……………………………………………… промышленности.
2 уровень
Установите формулу соли, если массовая доля кальция – 40%, углерода – 12% и кислорода – 48%.
Составьте уравнения химических реакций, схемы которых приведены ниже:
А) ZnO + ………………….. = ZnSO4 + ………………….
Б) MgO + …………………. = Mg(NO3)2 = ……………….. + H2O
В) CaCL 2 + ALPO4 = …………………. + ……………………….
Г) CuSO4 + ………………… = Cu(OH)2 + ……………………….
3 уровень
Раствор поваренной соли массой 125г с массовой долей растворенного вещества 5% разбавили водой, масса которой равна 25г. Определите массовую долю поваренной соли в растворе после разбавления.
Требуется приготовить 300г 10%-ного раствора поваренной соли из 45%-ного раствора. Какой объем воды необходимо взять для разбавления?

 Получите свидетельство
Получите свидетельство Вход
Вход




 Дано: Решение
Дано: Решение

 Дано Решение
Дано Решение
 Дано: Решение
Дано: Решение
 Дано Решение
Дано Решение
 Дано Решение
Дано Решение


 Дано Решение Формула
Дано Решение Формула








 Рабочая тетрадь по химии (0.44 MB)
Рабочая тетрадь по химии (0.44 MB)
 0
0 1226
1226 192
192 Нравится
0
Нравится
0


