КОНТРОЛЬНАЯ РАБОТА ПО ХИМИИ ДЛЯ УЧАЩИХСЯ 11 КЛАССА СРЕДНЕЙ ОБЩЕОБРАЗОВАТЕЛЬНОЙ ШКОЛЫ
Пояснительная записка
Контрольная работа призвана помочь учителю, образовательным учреждениям в оценке степени готовности учащихся к ЕГЭ по химии. Она проверяет знания учащихся по темам «Строение вещества» и «Основные классы неорганических веществ». Контрольная работа направлена на проверку следующих элементов знаний учащихся, включенных в спецификацию экзаменационной работы ЕГЭ по химии:
Современные представления о строении атомов.
Строение электронных оболочек атомов элементов первых четырех периодов.
Электронная конфигурация атома и иона.
Периодический закон и периодическая система химических элементов Д.И. Менделеева.
Радиусы атомов, их периодические изменения в системе химических элементов.
Закономерности изменения химических свойств элементов и их соединений по периодам и группам
Образование ионной связи
Электроотрицательность.
Степень окисления и валентность химических элементов.
Вещества молекулярного и немолекулярного строения.
Зависимость свойств веществ от особенностей их кристаллической решетки.
Классификация неорганических веществ.
Характерные химические свойства простых веществ-металлов: щелочных, щелочноземельных, алюминия, переходных металлов - меди, цинка, хрома, железа.
Характерные химические свойства простых веществ-неметаллов: водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния.
Контрольная работа рассчитана на 45 минут. Она состоит из 17 заданий, среди которых 10 заданий типа А, пять задания типа В, 2 задания типа С.
Задание А предполагает выбор одного правильного ответа из 4-х.
При решении заданий части В нужно установить соответствие между элементами правого и левого столбца таблицы, записать последовательность цифр или ответ к задаче. Каждое правильно выполненное задание части А оценивается в 1 балл. Каждое правильно выполненное задание части В оценивается в 2 балла, если все четыре соответствия установлены верно. Если учащийся, верно определил три соответствия, то такое выполнение оценивается в 1 балл. Каждое правильно выполненное задание части С оценивается в 3 балла.
Таким образом, необходимо выполнить
На «5» - «отлично» 7 заданий части А (7 баллов)
2 задания части В (4 балла)
1 задание части С. (3 балла)
Итого: 14 и более баллов
«4» - «хорошо» 8- 11 баллов
«3» - «удовлетворительно» 5-7 баллов
Ответы
| Задание | Вариант 1 | Вариант 2 |
| А1 | 4 | 2 |
| А2 | 3 | 3 |
| А3 | 4 | 3 |
| А4 | 1 | 3 |
| А5 | 1 | 3 |
| А6 | 3 | 4 |
| А7 | 1 | 4 |
| А8 | 3 | 3 |
| А9 | 2 | 4 |
| А10 | 3 | 3 |
| В1 | 246 | 256 |
| В2 | 6514 | 7812 |
| В3 | 3461 | 1483 |
| В4 | 24 | 35 |
| В5 | 8 | 22 |
| С1 | Fe – окислитель, S - восстановитель | N – окислитель, S - восстановитель |
| С2 | 14 | 71 |
| С3 | 11,28% | 18,54% |
Таблица поэлементного анализа
| Задание | Элементы знаний | Правильно выполнили (чел) | % выполн. элемента |
| А1 | Электронная конфигурация атома и иона |
|
|
| А2 | Строение электронных оболочек атомов элементов первых четырех периодов. |
|
|
| А3 | Закономерности периодической системы Д.И. Менделеева |
|
|
| А4 | Химическое равновесие и способы его смещения |
|
|
| А5 | Типы кристаллических решёток |
|
|
| А6 | Электролитическая диссоциация |
|
|
| А7 | Химические свойства веществ |
|
|
| А8 | Характерные свойства вещества. |
|
|
| А9 | Типы химических реакций в органической химии |
|
|
| А10 | Классификация органических веществ |
|
|
| В1 | Химические свойства органических веществ |
|
|
| В2 | Классификация неорганических веществ |
|
|
| В3 | Реакции ионного обмена |
|
|
| В4 | Изомерия и гомология в органической химии |
|
|
| В5 | Массовая доля растворённого вещества (Задача) |
|
|
| С1 | ОВР. Метод электронного баланса |
|
|
| С2 | Задача на выход продукта от теоретически возможного |
|
|
| С3 | Комплексная задача |
|
|
Инструкция по выполнению работы
На выполнение контрольной работы по химии дается 45 минут. Работа состоит из 3 частей и включает 15 заданий.
Часть А включает 10 заданий (А1 – А10). К каждому заданию дается 4 варианта ответа, из которых, только один правильный.
Часть В состоит из 5 заданий (В1 – В5), на которые надо дать краткий ответ в виде последовательности цифр. В этой части используются задания на установление соответствия.
Внимательно прочитайте каждое задание и предлагаемые варианты ответа. Отвечайте только после того, как вы поняли вопрос и проанализировали все варианты ответа.
Выполняйте задания в том порядке, в котором они даны. Для экономии времени пропускайте задание, которое не удается выполнить сразу, и переходите к следующему. К пропущенному заданию вы сможете вернуться после выполнения всей работы, если останется время.
При выполнении работы вы можете пользоваться периодической системой химических элементов Д.И. Менделеева, таблицей растворимости солей, кислот и оснований в воде, электрохимическим рядом напряжений металлов, а также калькулятором.
За выполнение заданий группы А дается один балл. Выполнение заданий группы В оценивается в 2 балла.
Баллы, полученные вами за выполненные задания, суммируются. Постарайтесь выполнить как можно больше заданий и набрать наибольшее количество баллов.
Вариант № 1
Часть А (каждое задание 1 балл)
А1. Электронная конфигурация 1s22s22p63s23p6 соответствует частице
| 1) | Li+ | 2) | K+ | 3) | Cs+ | 4) | Na+ |
А2. Число энергетических уровней и число внешних электронов атома хлора равны соответственно
| 1) | 4, 6 | 2) | 2, 5 | 3) | 3, 7 | 4) | 4, 5 |
А3. В каком ряду химические элементы расположены в порядке возрастания их атомного радиуса?
| 1) | Na, Mg, Al, Si 2) Li, Be, B, C |
| 3) | P, S, Cl, Ar 4) F, O, N, C |
А4. В системе 2SO2(г) + O2(г) 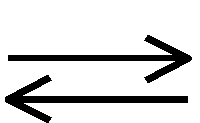 2SO3(г) + Q
2SO3(г) + Q
смещению химического равновесия в сторону исходных веществ будет способствовать
| 1) | уменьшение давления 2) уменьшение температуры |
| 3) | увеличение концентрации SО2 4) уменьшение концентрации SO3 |
А5. Атом является структурной частицей в кристаллической решетке
| 1) | метана | 2) | водорода | 3) | кислорода | 4) | кремния |
А6. Только сильные электролиты представлены в ряду
| 1) | Cu(OH)2, NaCl, H3PO4 2) FeCl3, H2S, NaOH |
| 3) | Na2SO4, HNO3, NaOH 4) KNO3, H3N, Mg(OH)2 |
А7. Химическая реакция возможна между
1) оксидом марганца(VII) и оксидом калия
2) оксидом кремния и водой
3) оксидом углерода(IV) и оксидом серы(VI)
4) оксидом фосфора(V) и оксидом серы(VI)
A8. Верны ли следующие суждения о гидроксиде цинка? А. Гидроксид цинка растворяется в серной кислоте. Б. Гидроксид цинка растворяется в щелочи натрия.
верно только А
верно только Б
верны оба суждения
оба суждения неверны
А9. Превращение бутана в бутен относится к реакции
| 1) | полимеризации 2) дегидратации |
| 2) | дегидрирования 4) изомеризации |
А10. К полисахаридам относится
1) дезоксирибоза 3) целлюлоза
2) галактоза 4) мальтоза
Часть В (каждое задание 2 балла)
В1. Для метана характерны:
| 1) | реакция гидрирования |
| 2) | тетраэдрическая форма молекулы |
| 3) | наличие π- связи в молекуле |
| 4) | sp3-гибридизация орбиталей атома углерода в молекуле |
| 5) | реакции с галогеноводородами |
| 6) | горение на воздухе |
Ответ: ________________ . (Запишите цифры в порядке возрастания.)
В2. Установите соответствие между названием вещества и классом неорганических соединений, к которому оно принадлежит.
НАЗВАНИЕ ВЕЩЕСТВА КЛАСС СОЕДИНЕНИЙ
А) аммиак 1) щелочь
Б) соляная кислота 2) основный оксид
В) гидроксид натрия 3) основание
Г) оксид хрома(Ш) 4) амфотерный оксид
кислоты
летучее водородное соединение
В3. Установите соответствие между реагентами и сокращенными ион-
ными уравнениями реакций.
РЕАГЕНТЫ УРАВНЕНИЕ
Na2S и НСl 1) Сu2+ + 2ОН- = Сu(ОН)2
Б) Ва(ОН)2 и Na2SO4 2) CO32- + 2Н+ = СО2 + Н2О
K2CO3 и HNO3 3) S2- + 2Н+ = H2S
Г) CuSO4 и NaOH 4) Ва2+ + SO42- = BaSO4
2Na+ + SO42- = Na2SO4
СО3 2- + 2H+= H2CO3
В4. Изомерами являются пары веществ:
1) метаналь и метанол 4) бутен – 1 и 2- метилпропен
2) бутанол и диэтиловый эфир 5) этилацетат и бутанон-2
3) циклогексан и гексан 6) циклогексан и гексин
В5. При добавлении 300 г воды к 340 г 15 % - ного раствора мальтозы, получили раствор с массовой долей ________%. (Запишите число с точностью до целых.)
Часть С (каждое задание 3 балла)
C1. Используя метод электронного баланса, составьте уравнение реакции:
FeCl3 + H2S = FeCl2 + S + HCl
Определите окислитель, восстановитель.
С2. Рассчитать массу металлического осадка, образовавшегося при нагревании 9,2 г уксусного альдегида и 15,9 г аммиачного раствора оксида серебра(I), если массовая доля выхода продукта составила 96% по сравнению с теоретически возможным.
C3 *. Рассчитайте массовую долю серной кислоты в растворе, полученном
смешением 200 мл 20 % -ного раствора серной кислоты плотностью
1,2 г/мл и 150 мл 10 %-ного раствора нитрата бария плотностью 1,04 г/мл.
Вариант № 2
Часть А (каждое задание 1 балл)
А1. Электронная конфигурация 1s22s22p63s23p6 соответствует частице
| 1) | N–3 | 2) | Cl– | 3) | S+4 | 4) | Na+ |
А2. Число энергетических уровней и число внешних электронов алюминия равны соответственно
| 1) | 2, 1 | 2) | 2, 3 | 3) | 3, 3 | 4) | 3, 2 |
А3. В порядке возрастания атомного радиуса химические элементы расположены в ряду:
| 1) | Be, B, C, N |
| 2) | Rb, K, Na, Li |
| 3) | O, S, Se, Te |
| 4) | Mg, Al, Si, Р |
А4. При повышении давления равновесие смещается вправо в системе
| 1) | 2CO2(г)  2CO(г) + O2(г) 3) PCl3(г) + Cl2(г) 2CO(г) + O2(г) 3) PCl3(г) + Cl2(г)  PCl5(г) PCl5(г) |
| 2) | С2Н4(г)  С2Н2(г) + Н2(г) 4) H2(г) + Сl2(г) С2Н2(г) + Н2(г) 4) H2(г) + Сl2(г)  2 HCl(г) 2 HCl(г) |
А5. Кристаллическая решетка графита
| 1) | ионная 2) молекулярная |
| 3) | атомная 4) металлическая |
А6. Только слабые электролиты представлены в ряду
| 1) | H2SO4, KNO3, NaOH 3) H2S, AlCl3, КОН |
| 2) | HCl, Cu(OH)2, H2O 4) H2SO3, H2O, Mg(OH)2 |
А7. И бутан, и бутилен реагируют с
| 1) | бромной водой 3) водородом |
| 2) | раствором KMnO4 4) хлором |
А8. Верны ли суждения о фосфоре?
А. Фосфор горит на воздухе с образованием P2O5.
Б. При взаимодействии фосфора с металлами образуются фосфиды.
1) верно только А. 3) верны оба суждения.
2) верно только Б. 4) оба суждения неверны.
А9. Превращение ацетилена в бензол относится к реакции
| 1) | полимеризации 2) дегидратации |
| 2) | дегидрирования 4) изомеризации |
А10. К алкенам относится
1) бензол 3) бутен - 1
2) бутадиен – 1,3 4) метан
Часть В (каждое задание 2 балла)
В1. Углеводороды ряда этилена будут реагировать с каждым из веществ, указанных в ряду:
| 1) | Br2, HCl, C3H8 4) HCOH, CH4, HBr |
| 2) | KMnO4, H2, H2O 5) H2, O2, HCl |
| 3) | NaH, C6H6, Br2 6) H2O, HCl, Br2 |
Ответ: _________________. (Запишите цифры в порядке возрастания.)
В2. Установите соответствие между названием вещества и классом неорганических соединений, к которому оно принадлежит.
НАЗВАНИЕ ВЕЩЕСТВА КЛАСС СОЕДИНЕНИЙ
А) серная кислота 1) щелочь
Б) хлорид натрия 2) основный оксид
В) гидроксид калия 3) основание
Г) оксид кальция 4) амфотерный оксид
кислоты
средние соли
В3. Установите соответствие между реагентами и сокращенными ион-
ными уравнениями реакций.
РЕАГЕНТЫ УРАВНЕНИЕ
А) CuSO4 и КOH 1) Сu2+ + 2ОН- = Сu(ОН)2
Б) Ва(ОН)2 и К2SO4 2) CO32- + 2Н+ = СО2 + Н2О
В) K2CO3 и HNO3 3) S2- + 2Н+ = H2S
Г) К2S и НСl 4) Ва2+ + SO42- = BaSO4
2К+ + SO42- = К2SO4
СО3 2- + 2H+= H2CO3
В4. Гомологами являются пары веществ:
1) пропаналь и пропан 4) бутен – 1 и бутадиен – 1,3
2) бутанол и этан 5) бутанон-2 и пентанон - 2
3) циклогексан и циклопропан 6) гексан и гексин
В5. При добавлении 450 г воды к 730 г 35 % - ного раствора хлорида калия, получили раствор с массовой долей ________%. (Запишите число с точностью до целых.)
Часть С (каждое задание 3 балла)
C1. Используя метод электронного баланса, составьте уравнение реакции:
HNO 3 + S = NO2 + SO2 + H 2O
Определите окислитель, восстановитель.
С2. Рассчитать массу уксусной кислоты, которую можно получить из 130 г 50% -ного уксусного альдегида, при взаимодействии его с аммиачным раствором оксида серебра, если массовая доля выхода уксусной кислоты составляет 80% по сравнению с теоретически возможным.
C3 *. Рассчитайте массовую долю серной кислоты в растворе, полученном
смешением 300 мл 25 % -ного раствора серной кислоты плотностью 1,2 г/мл и 100 мл 10 %-ного раствора нитрата бария плотностью 1,04 г/мл.
9

 Получите свидетельство
Получите свидетельство Вход
Вход












 Итоговая контрольная работа по химии (профильный уровень) (0.13 MB)
Итоговая контрольная работа по химии (профильный уровень) (0.13 MB)
 1
1 7061
7061 696
696 Нравится
0
Нравится
0


