
Алкены
Выполнил ученик 11 «А» класса
КГУ ОШ №61 г. Алматы
Фазылов Фарух
Руководитель учитель химии
Гайдук Сергей Николаевич
Содержание
- Строение алкенов
- Изомерия и номенклатура алкенов
- Физические свойства
- Получение
- Химические свойства
- Применение алкенов
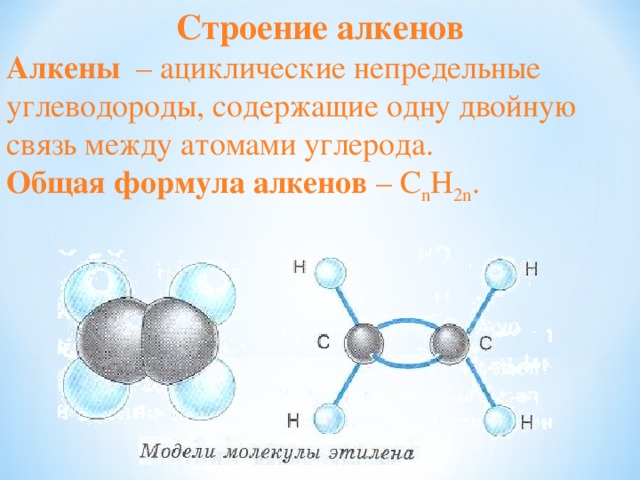
Строение алкенов
Алкены – ациклические непредельные углеводороды, содержащие одну двойную связь между атомами углерода.
Общая формула алкенов – C n H 2n .
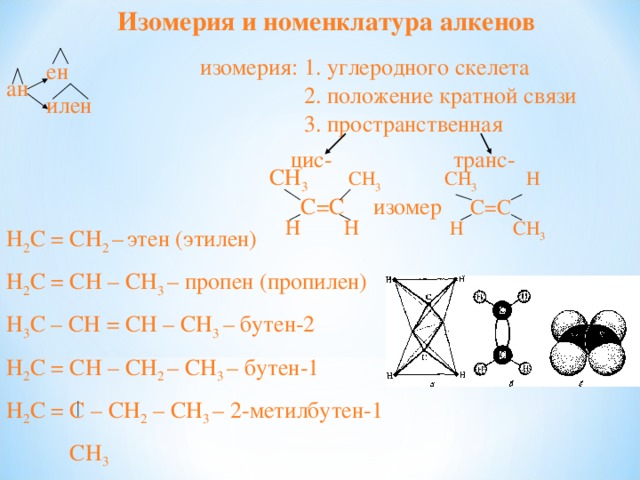
Изомерия и номенклатура алкенов
ен
ан
илен
изомерия: 1. углеродного скелета
2. положение кратной связи
3. пространственная
цис - транс -
СН 3 СН 3 СН 3 Н
С=С изомер С=С
Н Н Н СН 3
H 2 C = CH 2 – этен (этилен)
H 2 C = CH – CH 3 – пропен (пропилен)
H 3 C – CH = CH – CH 3 – бутен-2
H 2 C = CH – CH 2 – CH 3 – бутен-1
H 2 C = C – CH 2 – CH 3 – 2-метилбутен-1
CH 3

Физические свойства
Формула название
Температура кипения
C 2 H 4 - этилен
Агрегатное состояние
- 103,8
C 3 H 6 - пропилен
газы
- 47,7
C 4 H 8 - бутен
- 6,3; - 6,9
C 5 H 10 - пентен
+ 30,1; + 31,2
C 6 H 12 - гексен
+ 63,5
C 7 H 14 - гептен
жидкости
+ 93,6
C 18 H 36 - октадецен
C 19 H 38 - нонадецен
твердые
Этилен – бесцветный горючий газ со слабым запахом.
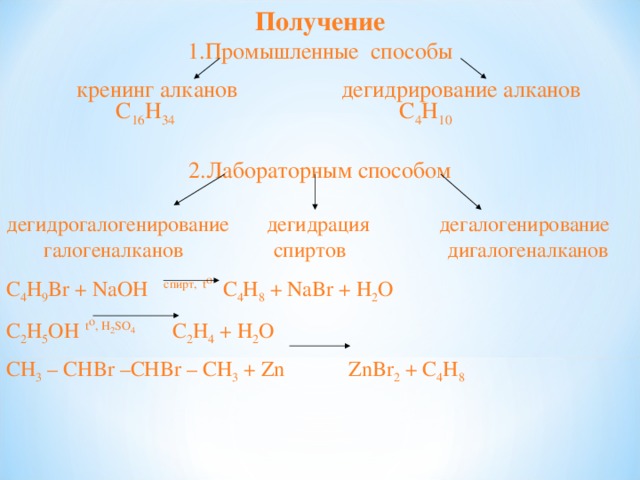
Получение
кренинг алканов дегидрирование алканов
C 16 H 34 C 4 H 10
дегидрогалогенирование дегидрация дегалогенирование
галогеналканов спиртов дигалогеналканов
C 4 H 9 Br + NaOH спирт, t o C 4 H 8 + NaBr + H 2 O
C 2 H 5 OH t o , H 2 SO 4 C 2 H 4 + H 2 O
С H 3 – CHBr –CHBr – CH 3 + Zn ZnBr 2 + C 4 H 8

Химические свойства
Химические свойства алкенов определяются строением и свойствами двойной связи С=С, которая значительно активнее других связей в молекулах этих соединений. Алкены химически более активны, чем алканы.
Для алкенов наиболее характерны реакции, протекающие за счет раскрытия менее прочной p -связи. При этом p -связь (в исходном алкене) преобразуется в s -связь в продукте реакции. Исходное ненасыщенное соединение превращается в насыщенное без образования других продуктов, т.е. происходит реакция присоединения.
Реакция присоединения
Окисление алкенов
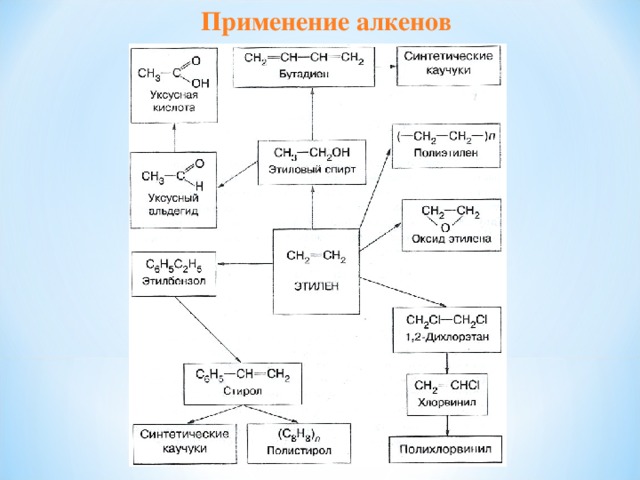
Применение алкенов

Основные источники информации:
http://ru.wikipedia.org/wiki/ Алкены
http://www.niikm.ru/articles/element_articles/ethylene/
http://www.turbopro.ru/itk/itk_02_08/2004/ceeva_ann/alkenreak.htm
http://www.chemistry.ssu.samara.ru/chem2/u44.htm
https://sites.google.com/site/himulacom/zvonok-na-urok/10-klass---tretij-god-obucenia/urok-no13-fiziceskie-i-himiceskie-svojstva-alkenov


 Получите свидетельство
Получите свидетельство Вход
Вход





















 Алкены (2.06 MB)
Алкены (2.06 MB)
 0
0 1121
1121 84
84 Нравится
0
Нравится
0


