Цели:
Образовательные: сформировать представления о металлах как химических элементах и металлах как простых веществах. Познакомить учащихся со строением и физическими свойствами металлов, исходя из положения их в ПСХЭ и строения атомов.
Дать понятия о металлической связи и металлической кристаллической решетки, некоторые способы получения металлов.
Развивающие: совершенствовать умения учащихся обобщать, делать выводы, анализировать, сравнивать, устанавливать причинно-следственную зависимость между составом, строением и свойствами веществ.
Воспитательные: создание условий для осознания необходимости грамотного отношения к своему здоровью и окружающей среде.
Ход урока:
Актуализация знаний. Слайд №1
Загадка:
Пахать и строить, все он может,
Если ему огонь в этом поможет.
-О каких элементах мы будем сегодня говорить?
Вы правильно определили тему нашего разговора, но я бы хотела ее немного конкретизировать: Мы будем изучать положение металлов в ПСХЭ, строение их атомов, металлическую связь и физические свойства металлов. Запишите в тетрадь тему урока и Д/З.
Слайд №3
2. Положение металлов в ПСХЭ.
Задание: рассмотрите положение элементов -металлов в ПСХЭ.
-Какое место занимают металлы в ПСХЭ?
(левая и нижняя часть таблицы,
-В каких группах они расположены? ( в основном в 1,2,3 группах).
3. Особенности строения атомов металлов.
Задание: определите распределение электронов по энергетическим уровням у следующих элементов.
Вывод: атомы металлов имеют большой радиус и малое число электронов (1-3 е) на последнем уровне.
Исключение составляют атомы олова Sn,свинца Pb, германия Ge – 4 электрона, сурьмы Sb и висмута Bi –
5 электронов, полония Ро – 6 электронов.
Задание: какие свойства будут проявлять атомы металлов в химических реакциях –окислительные и восстановительные? Почему? ( Ме легко отдают наружные электроны и превращаются в положительно заряженные ионы).
4. Металлическая связь. Металлическая кристаллическая решетка.
Слайд №4-5
Учитель: - Оторвавшиеся от атомов электроны относительно свободно передвигаются между положительно заряженными ионами металлов. Между этими частицами возникает связь, т.е. электроны как бы цементируют отдельные слои положительно заряженных ионов, которые находятся в узлах кристаллических решеток. Т.К. электроны находятся в непрерывном движении, то при их столкновении с положительно заряженными ионами последние превращаются в электронейтральные атомы, а затем опять в ионы и т.д.
Определение металлической связи: Словарная работа.
Металлическая связь – это связь, которую осуществляют относительно свободные электроны между ионами металлов, образующих кристаллическую решетку.
Вывод: частицы металлов связаны особым видом связи – металлической связью. В узлах кристаллических решеток металлов находятся положительно заряженные ионы металлов и электронейтральные атомы, между которыми передвигаются относительно свободные электроны. Такая решетка называется металлической.
5. Физические свойства металлов.
Учитель: Особое строение кристаллических решеток металлов обусловливает их общие физические свойства.
Слайд№6 А) Металлический блеск. Объясняется тем, что металлы хорошо отражают от своей поверхности световые лучи. ( и радиоволны – самолеты видны в радиолокаторах).
Слайд№7 Б) Электропроводность. Ме – хорошие проводники Эл. Тока.
Электропроводность увеличивается в ряду:
Hg, Pb, Fe, Zn, Mg, Al, Au, Cu, Ag
Слайд №8 В) Теплопроводность обусловлена большой подвижностью электронов, которые сталкиваясь с колеблющимися атомами и ионами обмениваются с ними энергией. Происходит выравнивание температуры по всему куску металла .
Слайд №9 Г) Пластичность и ковкость. Объясняется особенностью металлической связи. Т.к. ионы в решетке друг с другом не связаны, отдельные слои их могут свободно перемещаться относительно друг друга. Это свойство используется при механической обработке металлов.
Многие металлы ковкие ( щелочные, золото, серебро, медь), но хром, марганец, сурьма очень хрупкие. В чем причина?
-Сравните положение этих металлов в ПСХЭ. ( работа с ПСХЭ).
Вывод: У атомов этих элементов в отличие от 1-3 электронов у металлов 1-3 групп имеется от 5 до 7 свободных электронов, что обеспечивает прочность некоторых слоев ионов.
Слайд №10 Д) Температура плавления и плотность. Различны. Если плотность Ме меньше 5 – его считают легким, больше 5 – тяжелым. Наименьшую плотность имеют щелочные металлы, наибольшую – осмий.
Самую низкую Т плавл. Имеет ртуть, самую высокую – вольфрам ( градусник и лампочка).
6. Нахождение металлов в природе и способы их получения.
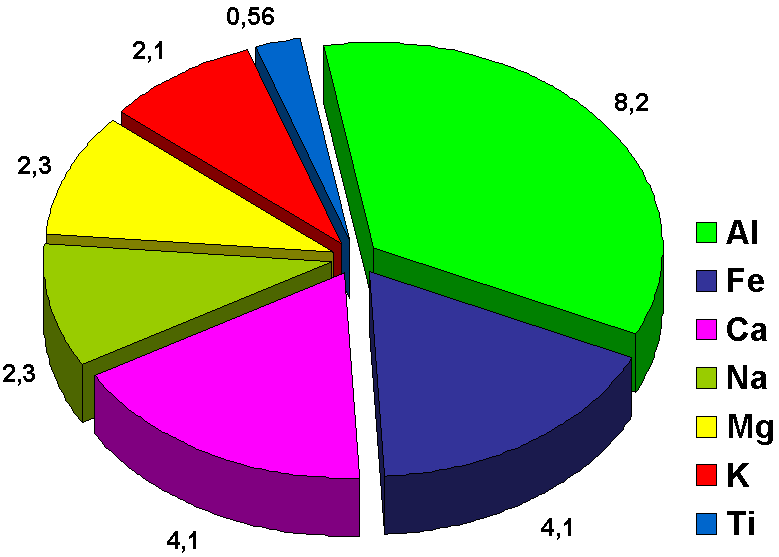
Слайд№11. Многие металлы широко распространены в природе.
Содержание некоторых металлов в земной коре (%) отображено на диаграмме.
Слайд№12. В природе металлы встречаются в различном виде: активные в виде солей, средней активности в виде оксидов и сульфидов, благородные – в свободном виде.
Наиболее активные металлы получают электролизом растворов их солей. Менее активные восстанавливают из их оксидов углем, оксидом углерода (П) или алюминием. Сульфиды сначала обжигают. Благородные металлы встречаются в свободном виде.
7. Закрепление нового материала. Тест.
1. Какая из следующих групп химических элементов содержит только металлы?
а) Cs, Be, B; б) K, Ca, Sr;
в) H, Li, Na; г) Ni, W, Pb.
2. Какое место занимают металлы в ПСХЭ:
а) слева в нижней части
б) справа в верхней части
в) по центру
г) слева в верхней части.
3. Наименьшее число электронов на наружном энергетическом уровне содержит:
а) Ca б) Сr в) Na г) Al
4. Металлическая кристаллическая решетка содержит
а) только ионы металлов б) атомы и ионы металлов
в) электроны, атомы и ионы металлов г) электроны и атомы металлов.
5. Установите соответствие:
Слайд №13. Ключ к тесту.
8. Подведение итогов. Оценка деятельности учащихся.
Лист самоанализа
9. Рефлексия.
Слайд №14. Минутка занимательной химии:
Отгадай загадки.
Первый слог – предлог известный,
Слог второй трудней найти: Часть его составит цифра,
К ней добавьте букву «Й»,
Чтобы целое узнать,
Надо вам металл назвать…
Натрий
12 пар – не забывай!
У всех людей на свете.
В другом значении – узкий край,
Так учат в школе дети.
Если «Се» ко мне добавить –
Вмиг в металл я превращусь,
А к тому хочу добавить –
В первой группе нахожусь…
Серебро
В старину ценилась дорого,
Цветом красная, как золото,
Постоянно с ним дружна,
В электротехнике нужна.
Медь
Это интересно!
Человек использовал металлы с древних времен.
1.В начале был век медный.
К концу каменного века человек открыл возможность использования металлов для изготовления орудий труда. Первым таким металлом был медь.
Период распространения медных орудий называют энеолитом или халколитом, что в переводе с греческого означает «медь». Медь обрабатывалась с помощью каменных орудий методом холодной ковки. Самородки меди превращались в изделия под тяжёлыми ударами молота. В начале медного века из меди делали лишь мягкие орудия, украшения, предметы домашней утвари. Именно с открытием меди и других металлов стала зарождаться профессия кузнеца.
Позже появились литья, а потом человек стал добавлять к меди олово или сурьму, делать бронзу, более долговечную, прочную, легкоплавкую.
II. Далее идёт век бронзовый.
Бронза - сплав меди и олова. Хронологические границы бронзового века датируются в начале 3-го тысячелетия до н. э. до начала 1-го тысячелетия до н.э. Большими преимуществами бронзы в сравнений с медью и другими известными металлами являются более низкая анализы показали, что в составе железных метеоритов на долю железа приходится 91% . Начало производства железа из его руд в Древнем Египте, потом в Индии и в других странах. Температура плавления ( 700° - 900° ) и высокие литейные качества и большая прочность.
III. Далее идет железный век.
Третий и последний период первобытной эпохи характеризуется распространением железной металлургии и железных орудий и знаменует собой железный век. В современном значении этот термин был введен в употребление в середине IX века датским археологом К.Ю. Томсоном и вскоре распространился в литературе наряду с терминами « каменный век» и « бронзовый век».
В отличие от других металлов железо, кроме метеоритного не встречается в чистом виде. Ученые предполагают, что первое железо, попавшее в руки человека, было метеоритного происхождения, и не зря железо именуется «небесным камнем». Самый крупный метеорит нашли в Африке, он весил около шестидесяти тонн. А во льдах Гренландии нашли железный метеорит весом тридцать три тонны.
В настоящее время продолжается железный век. Ведь в настоящее время железные сплавы составляют почти 90% всего количества металлов и металлических сплавов.
Весь материал - в документе.

 Получите свидетельство
Получите свидетельство Вход
Вход













 Положение металлов в ПСХЭ. Металлическая связь. Физические свойства металлов (70.5 КB)
Положение металлов в ПСХЭ. Металлическая связь. Физические свойства металлов (70.5 КB)
 0
0 2765
2765 552
552 Нравится
0
Нравится
0


