Задачи:
1. Закрепить навыки в составлении уравнений гидролиза. Ещё раз пояснить механизм и смысл гидролиза, а также систематизировать и обобщить знания по изучению темы.
2. Развивать навыки самостоятельного применения знаний, навыки в расстановке коэффициентов, в составлении формул.
3. Воспитать интеллект, и мыслительные способности, умение уважать мнение другого, помочь ему в освоении материала.
Урок: Комбинированный, а также систематизированный и обобщённый.
Методы:
Беседы;
Семинар;
Письменные работы;
Исследовательно-поисковая;
Оборудование: периодическая таблица, таблица растворимости веществ, сборник задач, М.Гаврусейко, электронный учебник, реактивы.
План:
А) Применение обобщенной теории – немного из дополнительного материала.
Б) Перейти к гидролизу солей.
Обобщенная теория кислот и оснований М.И.Усановича. позволяет определить среду растворов большинства солей – в зависимости от накопления в растворе тех или иных ионов, определяющих либо, кислотный, либо основной, либо нейтральный характер.
В) используя реактивы: провожу наглядно опыты по гидролизу записываем в таблицу.
I опыт: В чистую пробирку наливаем немного соды Na2CO3 и добавляю столько же раствора лакмуса.
Наблюдение – раствор стал синего цвета.
Следовательно, раствор имеет щелочную среду.
II опыт: В чистую пробирку наливаем немного раствора медного купороса – CuSO4 добавляю такое же количество лакмуса.
Наблюдение: раствор покраснел.
Следовательно, раствор имеет кислую среду.
III опыт: В чистую пробирку наливаем немного раствора поваренной соли – NaCl, добавляем лакмус.
Наблюдение: раствор не меняет цвета.
Следовательно, раствор имеет нейтральную среду.
- Пояснить смысл наблюдаемых изменений. Выводы записываются в тетради.
- Учу составлять уравнение гидролиза данных солей:
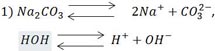
Правило №1: Если соль образована сильным основанием и слабой кислотой, то гидролиз заключается в связывании ионов H+ молекулы H2O кислотных остатков и высвобождением в раствор свободных OH-. В данном случае среда будет основной.
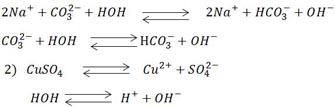
Правило №2: Если соль образована слабым основанием и сильной кислотой, то гидролиз заключается в связывании гидроксид ионов молекулы воды катионов металлов и высвобождением в раствор свободных H+. В данном случае средне кислая.
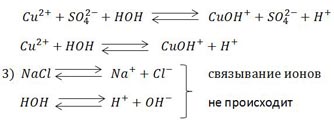
Правило №3: Если соль образована сильным основанием и сильной кислотой, то такая соль гидролизу не подвергается.
На закрепление предлагается выполнить задания из сборника задач М.Гаврусейко – поочередное выполнение с приглашением к доске
р №6; в1, зад. 4-5
Самостоятельная работа по вариантам.
Определите среду раствора и напишите уравнения гидролиза следующих солей:
I вариант II вариант
MgCl2 Hg(NO3)2
JnS AlCl3
KNO3 CaSO3
LiPO4 BaCl2
Рассмотреть, как ОВД процессы взаимодействие следующих вариантов - смотри документ.
Решить задачу:
При сгорании метана CH4 выделяется углекислый газ. Определить его объем при н.у.
Работа с электронным учебником.
Итог урока, оценки
Домашнее задание: задания из сборника М. Гаврусейко. Р. №4,в1,2; р. № 5, в1,2.

 Получите свидетельство
Получите свидетельство Вход
Вход



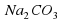 и добавляю столько же раствора лакмуса.
и добавляю столько же раствора лакмуса.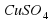 добавляю такое же количество лакмуса.
добавляю такое же количество лакмуса.

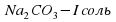
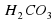
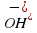
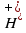 , среда щелочная
, среда щелочная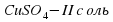
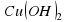
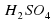
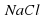



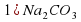 ,
,








 Применение обобщенной теории М.И.Усановича. Гидролиз солей (64.62 КB)
Применение обобщенной теории М.И.Усановича. Гидролиз солей (64.62 КB)
 0
0 416
416 21
21 Нравится
0
Нравится
0


