Образовательная цель: ознакомить учащихся со строением, физическими и химическими свойствами кальция, его получением и важнейшими соединениями.
Развивающая цель: углубить знания учащихся по теме, развитие познавательного интереса, логического мышления.
Воспитательная цель: правильное распределение времени учащимися, формирование ответственного отношения к учебе.
Ход урока:
«Единственный путь, ведущий к знанию, - это деятельность» (Б. Шоу)
О каком элементе сегодня мы будем говорить?
«Есть я в каждом вашем пальце, я в руках, в ногах, в зубах…»
«Я в яичной скорлупе,
И в нарзане я немножко,
Есть я мраморной колонне,
В меле, гипсе и бетоне…» (Кальций)
Сегодня совершим путешествие.
1 станция: «Периодическая».
Какое положение в периодической системе имеет кальций?
Элемент 4 периода, II А группы. Семейство – щелочноземельные металлы. Порядковый номер 20, в ядре 20 протонов и 20 нейтронов, общее число электронов 20. Электронная формула +20)2)8)8)2. 1s22s22p63s23p64s2. валентные электроны внешнего слоя
2 станция: «Физическая».
Какие физические свойства характерны для металла кальция?
Кальций – металл, серебристо-белый легкий металл (ρ = 1,54 г/см3). Более легко окисляется на воздухе, хранят под слоем керосина.
3 станция: «Природная».
В связи с физическими свойствами как распространен элемент в природе? (В виде соединений).
Найдите формулы?
Известняк, мел, мрамор - ? (СаСО3)
Гипс - ? (CaSO4 ∙ 2H2O)
Доломит - ? (СаСО3 ∙ MgCO3)
Флюарит - ? (СаF2)
4 станция: «Получение».
В виду его активности получают методом электролиза расплава.
Эл. ток
CaCl2 → Ca + Cl2↑
Катод (-) Са2+ + 2 е → Са0 восстанавливается
Анод (+) 2Cl- - 2 e → Cl20↑ окисляется
5 станция: «Химическая».
Кальций – активный металл, реагирует с простыми и сложными веществами.
Согласно схеме запишите уравнения химических реакций (смотри документ)
6 станция: «Соединения».
Важнейшими являются СаО и Са(ОН)2.
СаО – белое тугоплавкое вещество, его еще называют негашеной известью. Получают при обжиге известняка:
t
СаСО3 = СаО + СО2↑
Химические свойства:
Закончите уравнения:
СаО + Р2О5 → ? 3СаО + Р2О5 →Са3(РО4)2
СаО + Н2SO4 → ? CaO + H2SO4 → CaSO4 + H2О
CaO + H2O → ? CaO + H2O → Ca(OH)2
Реакцию взаимодействия СаО с водой называют гашением извести. Са(ОН)2 – известковое молоко, окрашивает фенолфталеин в малиновый цвет.
Химические свойства:
Диссоциация:
Са(ОН)2 → Са+2 + 2ОН-
Са(ОН)2 + СО2 = СаСО3↓ + Н2О
Это качественная реакция помутнения известкового молока:
Са(ОН)2 + 2HCl = CaCl2 + 2H2O
CaCО3 + H2O + CO2 = Ca(HCO3)2 гидрокарбонат кальция
Итак, мы ознакомились с соединениями кальция.
7 станция: «Вопросная».
- Элементом какой группы является кальций?
- Формула известняка и мрамора?
- Почему кальций не встречается в природе в чистом виде?
- Как получают кальций?
- С какими простыми веществами реагирует кальций?
- При взаимодействии кальция с какими сложными веществами выделяется водород?
- Назовите формулу негашеной извести?
- Как следует хранить известковую воду – в открытом или закрытом сосуде?
- Почему легкий и прочный металл как кальций не применяют в самолетостроении?
- Почему в новых домах вначале чувствуется повышение влажности?
Вывод по уроку:
Кальций – активный металл, имеет постоянную степень окисления +2. Образует соединения основного характера. Соединения используются в строительстве.
Это интересно:
В организме человека содержится 2% кальция, из них 99% в костях и зубах. Ионы способствуют свертыванию крови. При профилактике кариеса применяют пасты, содержащие фтор, они на эмали зубов образуют фторапатиты, они устойчивы к действию кислот и обладают бактерицидными свойствами.
Подведение итогов.
Домашнее задание.

 Получите свидетельство
Получите свидетельство Вход
Вход



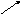 + H2 → ? Согласно схеме запишите уравнения химических реакций
+ H2 → ? Согласно схеме запишите уравнения химических реакций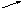 + O2 → ? взаимодействия кальция с простыми веществами и назовите их.
+ O2 → ? взаимодействия кальция с простыми веществами и назовите их. a + N2 → ?
a + N2 → ?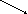
 + C → ?
+ C → ?








 Кальций и его соединения (43.5 КB)
Кальций и его соединения (43.5 КB)
 0
0 2491
2491 455
455 Нравится
0
Нравится
0


